滤泡起源的甲状腺癌NGS检出率超高!少见基因变异不遗漏,指导治疗预后及遗传
2024-06-10 苏州绘真医学 苏州绘真医学
本研究旨在确定较少发生的基因变异,以提高我们对TC基因组学的理解,并讨论可能影响非手术和手术治疗的靶向治疗的可能性。
甲状腺癌是最常见的内分泌恶性肿瘤,在分化良好的肿瘤中,丝裂原活化蛋白激酶(MAPK)和磷脂酰肌醇-3激酶(PI3K)/AKT信号通路常发生变异。在文献中很少发现驱动甲状腺癌的其他分子变异,且更可能发生在低分化或间变性病例中。本研究在乳头状甲状腺癌、低分化甲状腺癌和高级别分化型甲状腺癌患者中发现了MLH1、MSH2、NSD3::NUTM1、RET::SPECC1L和G3BP2::FGFR2等罕见基因变异。大多数此类肿瘤具有侵袭性生物学行为。甲状腺癌的非典型驱动突变可发生于癌症易感综合征患者,一名李-佛美尼综合征(Li Fraumeni syndrome)患者的NTRK1::TPM3融合证明了这一点。在这些侵袭性较强的疾病中,对可干预的融合和突变进行分子检测很重要。正如本病例队列所证明的,在被诊断为高级别甲状腺滤泡源性癌的病例中,100%存在与较差预后相关的突变或融合,或者存在需要进一步研究的胚系综合征关联,或者存在可干预的突变。在高级别甲状腺滤泡源性癌患者的这一分子检测队列中观察到的高检出率提示,对这一人群进行更常规的分子检测将是一种有益的临床实践。
研究背景
甲状腺癌(TC)是最常见的内分泌恶性肿瘤,大多数病例为分化良好的滤泡细胞来源的肿瘤,最常见的是乳头状甲状腺癌(PTCs),其次是滤泡性甲状腺癌(FTCs)。分化良好的TCs的分子发病机制涉及MAPK和PI3K/AKT信号通路的失调。TC的已知主要基因原因包括BRAF、RAS、RET、TERT和TP53基因突变。PTCs中最常见的突变是BRAF和RAS基因的点突变以及RET::PTC重排。另一方面,PI3K/AKT的激活被认为在FTC的启动中至关重要,可以通过RAS、PIK3CA和AKT1的激活突变以及PTEN的失活来触发,其中PTEN负调控该通路。FTCs中最常见的变异包括RAS突变和PAX8::PPARG重排。甲状腺髓样癌(MTC)起源于滤泡旁细胞,主要由RET基因突变驱动。TC的进展和去分化到低分化TC(PDTC)和间变性TC(ATC)涉及一些影响其他细胞信号通路的额外突变,如p53和Wnt/β-catenin。最近,TERT启动子突变在所有组织学TC类型中均有描述,在侵袭性和未分化的肿瘤中有显著较高的发生率。
大多数PTCs和FTCs的死亡率较低。然而,尽管治疗取得了进展,如高分化TC的多酪氨酸激酶抑制剂(仑伐替尼、卡博替尼和索拉非尼)和MTC的卡博替尼、凡德他尼和RET特异性抑制剂(塞普替尼),但仍有一部分患者最终出现疾病复发,并且这些患者的5年生存率仍然较差。此外,疾病分期较高或有远处转移的患者以及PDTC或ATC患者的死亡率高,且对于ATC,尤其是BRAF野生型病例,目前尚无统一的标准治疗。
本研究旨在确定较少发生的基因变异,以提高我们对TC基因组学的理解,并讨论可能影响非手术和手术治疗的靶向治疗的可能性。
研究结果
在一篇回顾性综述中,研究者从美国西北纪念医院(North-western Memorial Hospital)的肿瘤登记系统中确定了2021年1月至2023年12月期间的406例原发性TC:387例PTC、所有亚型、4例FC、2例嗜酸细胞型TC、1例分化型高级别TC、5例PDTC、1例ATC和6例MTC。41例肿瘤进行了BRAF突变的二代测序(NGS)以外的分子研究(Personal Genome Diagnostics(PGDx)elio Panel和FusionPlex Panel)。24%(10/41)的TC存在少见的基因突变和融合。表1和表2总结了临床和病理特征。
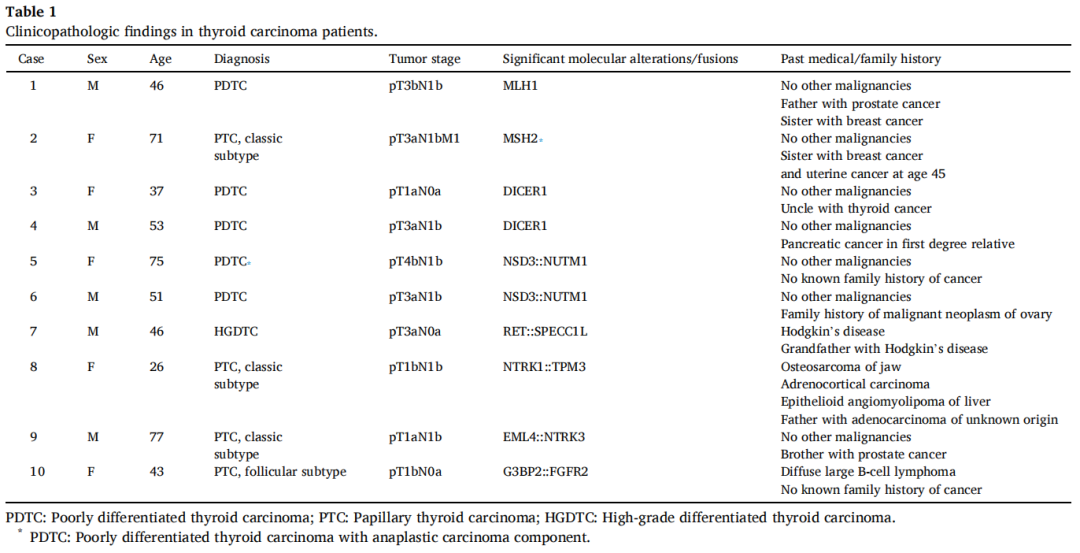
表1
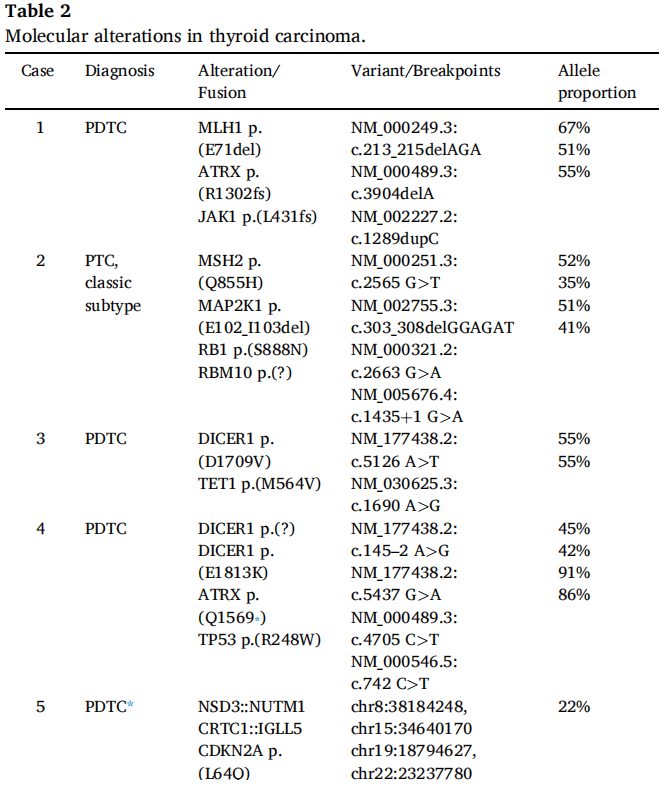

表2
携带错配修复(MMR)基因突变的甲状腺癌:
在2例TC中发现了MMR基因突变:一例PDTC(MLH1)和一例经典亚型PTC(MSH2)(表1)。PDTC表现为实性小梁和岛叶生长,由胞质嗜酸性和大囊泡核的细胞组成(图1A-C)。有丝分裂活性增加(每10个高倍视野有>3个有丝分裂)和多灶性肿瘤坏死。肿瘤侵犯带状肌,并转移至中央区和侧颈部多个淋巴结。免疫组织化学显示肿瘤细胞甲状腺球蛋白、TTF1、PAX8阳性(图1D)。图2显示了MLH1中3个碱基对缺失的分子结果。患者在初次诊断后存活23个月。近期胸部CT显示双侧肺结节疑似转移。
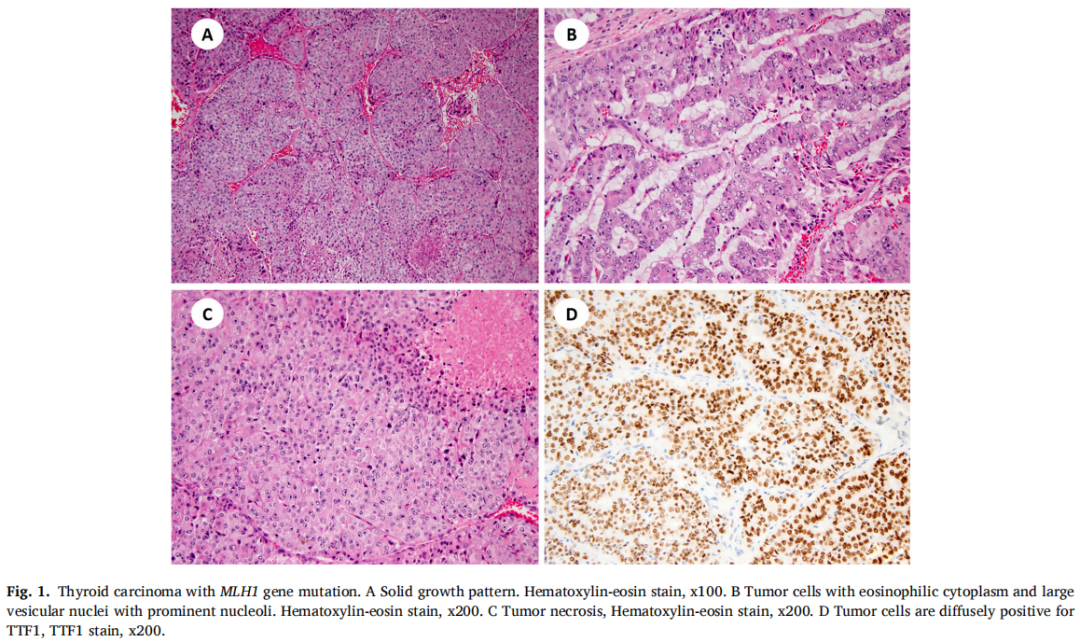
图1
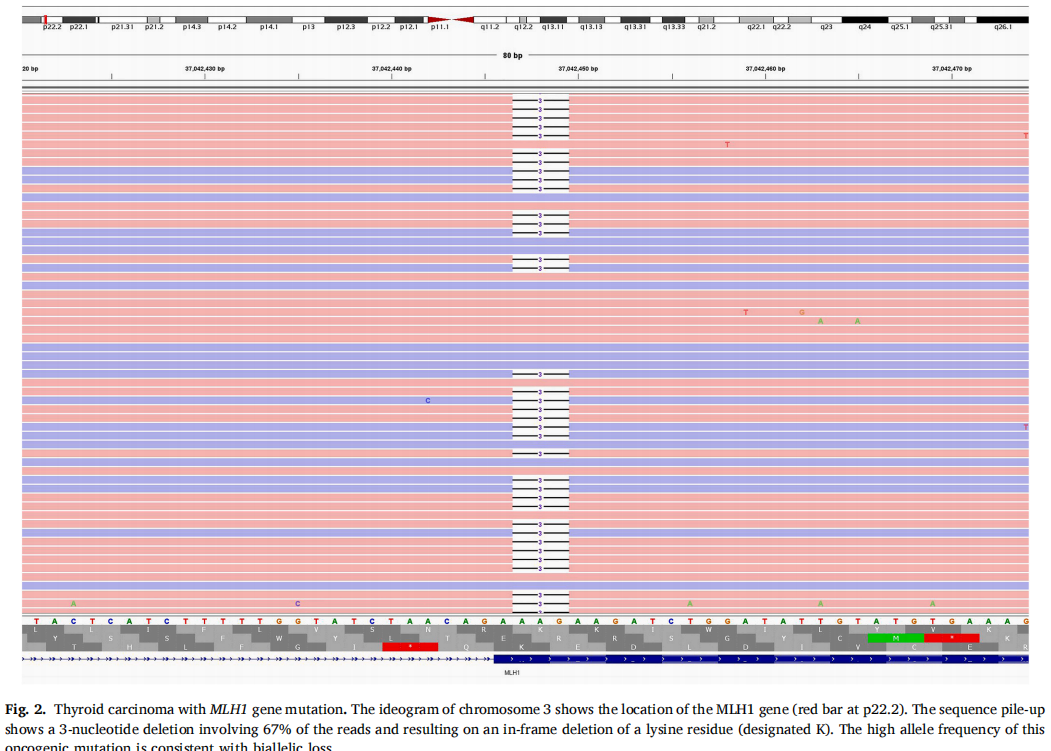
图2
PTC呈浸润性生长,具有PTC的特征性细胞核特征。肿瘤局限于甲状腺,并转移至多个中央区和侧颈部淋巴结。免疫组织化学显示肿瘤细胞甲状腺球蛋白和TTF1阳性。患者在15年期间发生多处肺、骨和脑转移。患者在初次诊断后16年死于该病。
携带MMR基因突变的TCs缺乏BRAF、RAS、RET、TP53和TERT变异(表2)。
携带DICER1突变的甲状腺癌:
在2例PDTC患者中发现了DICER1突变(表1)。肿瘤呈实性小梁状和岛状生长,由胞质嗜酸性的细胞和中等圆形或不规则(成角)核的细胞组成,细胞核染色质分散,有小核仁(图3A-C)。有丝分裂活性增加(每10个高倍视野有>3个有丝分裂)和多灶性肿瘤坏死。2个肿瘤均局限于甲状腺,1个转移至中央区和侧颈部多个淋巴结。免疫组织化学显示肿瘤细胞甲状腺球蛋白、TTF1、PAX8阳性(图3D)。低分期(pT1aN0a期)TC患者仍存活,无局部复发和远处转移证据。另1例高分期(pT3aN1b期)TC患者在初诊后21个月出现复发,气管前新发包块,锁骨上淋巴结及肺部远处转移。
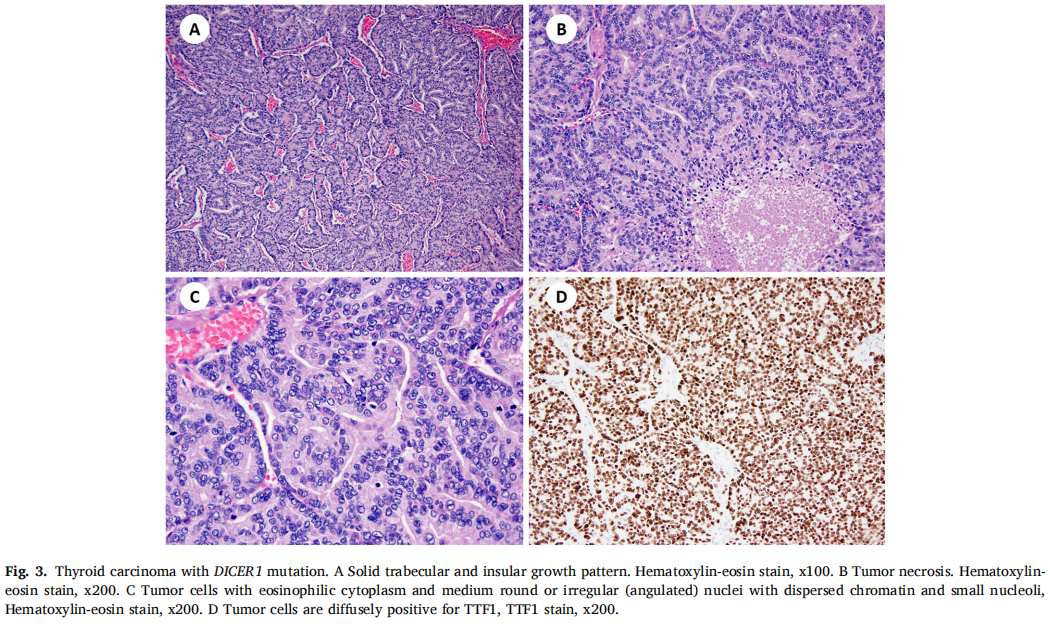
图3
携带DICER1突变的TCs缺乏BRAF、RAS、RET、TP53和TERT变异(表2)。
携带NUTM1重排的甲状腺癌:
NSD3::NUTM1融合在2例原发性TC患者中发现,伴有PDTC形态,表现为实性/小梁和岛状生长模式,坏死,每10个高倍视野有>3个有丝分裂(表1)。在1例肿瘤中发现了转化为未分化/ATC的区域,具有横纹肌样特征和粘液样基质(图4A-C)。常规HE染色及免疫组织化学染色均未见鳞状分化。肿瘤细胞PAX8、TTF1阳性(图4D),p40阴性。甲状腺球蛋白在ATC成分中表达缺失。含ATC成分的PDTC侵犯喉及椎前筋膜,包绕颈动脉。患者于确诊后8个月死亡。另1例患者在初步诊断后52个月仍存活,有疾病进展的临床证据。
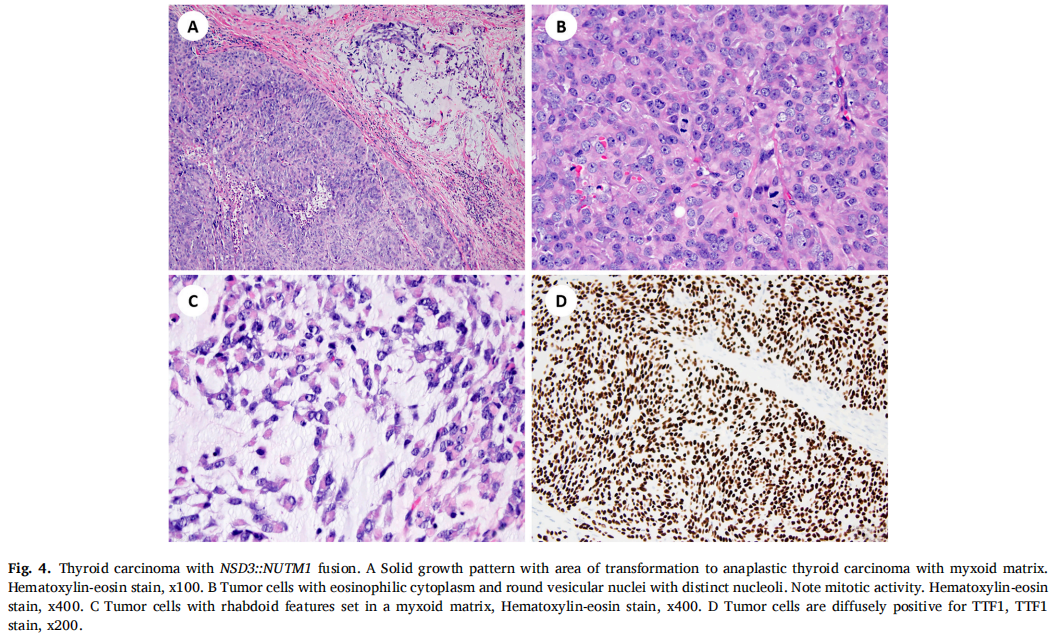
图4
NSD3::NUTM1融合的TCs缺乏BRAF、RAS、RET、TP53和TERT变异(表2)。通过基于RNA的NGS测序,这两个携带NSD3::NUTM1融合的TCs显示了相同的断裂点和融合转录本。该融合产物的代表性图像如图5所示。
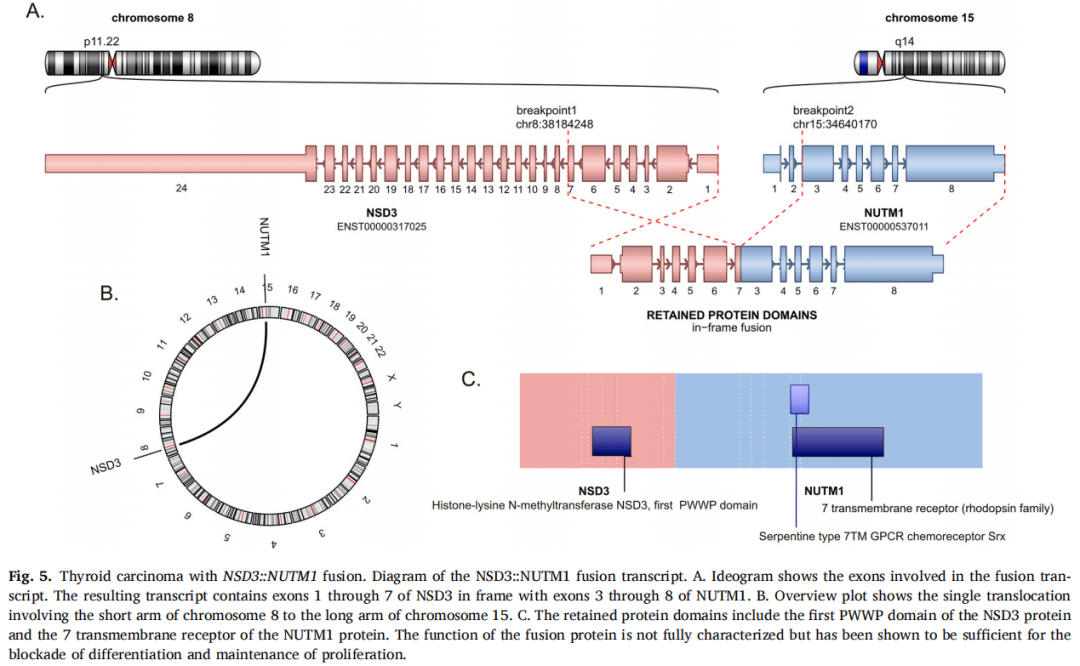
图5
携带RET::SPECC1L融合的甲状腺癌:
在1例分化型高级别滤泡细胞来源的TC患者中发现RET::SPECC1L融合(表1)。肿瘤显示侵袭性生长,由含有胶体的小至中型滤泡组成,内衬有PTC的细胞核特征的细胞。实性片状的肿瘤细胞具有PTC的典型核特征。有丝分裂活性增加(可达6个有丝分裂/2 mm2)。肿瘤细胞中CD56表达缺失(图6A-D)。患者在最初诊断后6个月仍存活,无疾病进展的证据。
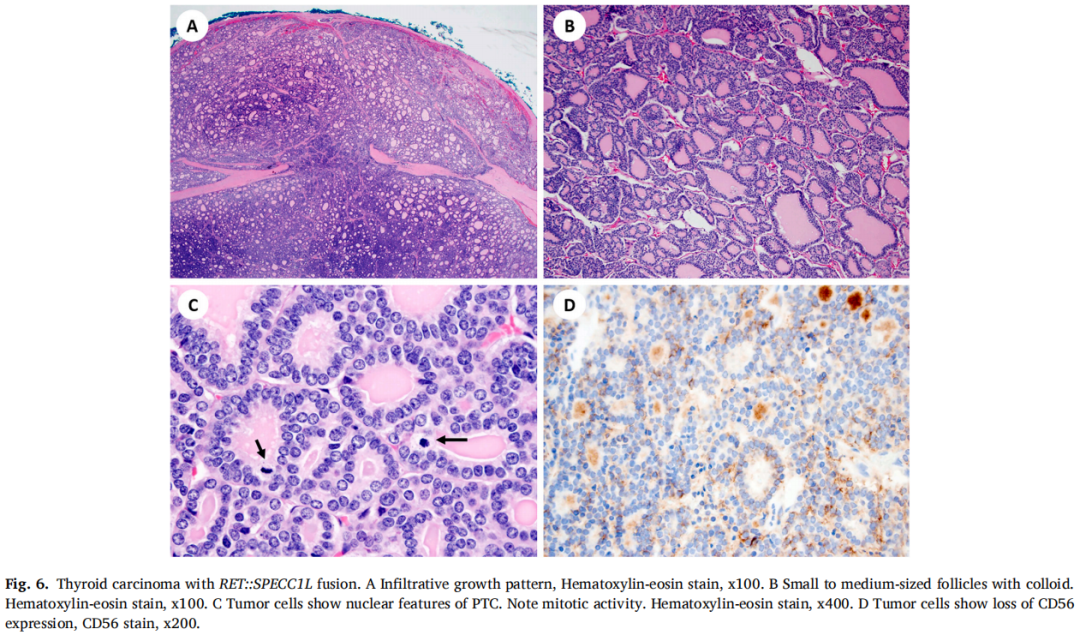
图6
携带RET::SPECC1L融合的TC缺乏BRAF、RAS、TP53和TERT变异(表2)。
携带NTRK融合基因的甲状腺癌:
在2例PTC中发现了NTRK融合基因(表1)。NTRK1::TPM3融合的PTC表现为乳头状生长模式,而NTRK3融合的PTC表现为乳头状和滤泡状混合生长模式。2例均具有典型的PTC细胞形态学特征(细胞核呈长形,染色质呈粉状,细胞核轮廓不规则,包括核槽、假包涵体、重叠及小核仁)。未见有丝分裂活性或坏死。
NTRK1::TPM3融合阳性PTC发生于1例既往有颌骨骨肉瘤、肾上腺皮质癌和肝上皮样血管平滑肌脂肪瘤病史的患者。免疫组织化学肿瘤PMS2表达缺失,TP53p.(R273L)突变阳性。患者的外周血和唾液检测显示TP53突变很可能是胚系,符合Li Fraumeni综合征。初次诊断后20个月发现疾病进展伴右颈部第3、4区淋巴结转移。另1例EML4::NTRK3融合患者在初诊后15个月仍存活且无疾病复发。
2例NTRK融合阳性TC的BRAF、RAS和RET突变均为阴性(表2)。
携带G3BP2::FGFR2融合的甲状腺癌:
1例PTC患者检测到G3BP2::FGFR2融合(表1)。肿瘤有包膜,完全滤泡生长方式,肿瘤被包膜侵犯,并具有PTC的细胞核特征,包括核增大、核重叠、染色质透明、核膜不规则和核沟。未见核分裂象和坏死。患者在初步诊断后5个月仍存活,没有疾病进展的证据。
G3BP2::FGFR2融合的TC缺乏BRAF、RAS、RET、TP53和TERT变异(表2)。
讨 论
滤泡细胞起源的癌占甲状腺肿瘤的大多数,根据形态学特征、分子谱和侵袭性分为高分化TC(PTC,浸润性包膜变异型PTC,FTC,嗜酸细胞癌)、高级别滤泡源性癌(PDTC,高级别分化TC)和ATC。大多数甲状腺癌具有特征性的基因变异,包括原癌基因(BRAF、NRAS、HRAS、KRAS)的点突变和染色体重排(包括RET::PTC1、RET::PTC3和PAX8::PPARG),这些变异因组织学亚型而异。PTCs具有多种形态亚型,是BRAF样恶性肿瘤的代表,而浸润性包膜滤泡变异型PTC和FTC则代表RAS样恶性肿瘤。CTNNB1和TP53的突变与PDTC和ATC的发生发展有关。形态学检查仍然是甲状腺病理日常常规诊断的中心,分子检测已经成功地大大改善了TC的术前和术后诊断和风险分层,并提出了最佳的治疗策略。
本研究发现的MLH1突变PDTC和MSH2突变PTC为首次和孤立的肿瘤疾病。MMR缺陷肿瘤可由胚系和散发性突变诱发。Lynch综合征是一种常染色体显性遗传病,其特征是发生结直肠癌和几种结肠外恶性肿瘤的风险显著增加,如子宫内膜癌、卵巢癌、输尿管癌、胃癌和小肠癌。在文献中报道的伴有MMR缺陷的TC病例中,已表明它们可能是Lynch综合征患者的当前表型,应进行胚系分析。在本文报告的两例中,未进行胚系检测。Lynch综合征是由MMR基因的胚系突变引起的,主要发生在MLH1和MSH2,很少发生在MSH6和PMS2。本研究中MLH1和MSH2突变的TC不携带BRAF、RAS、RET和TP53突变,表现出侵袭性行为和广泛转移。Lynch综合征相关TC的病例报道也显示,与高分化肿瘤相比,这些突变更容易在PDTC和ATC病例中发现。1例PTC患者在确诊后16年死于疾病。鉴于本研究中MLH1和MSH2突变的TC数量较少,因此必须谨慎解读这些结果,但结果提示MMR状态可能在TC中具有预后意义。
研究者在2例无其他肿瘤和化疗史的成人PDTC患者中发现了DICER1突变。DICER1的突变与多种多器官的肿瘤性和非肿瘤性疾病相关,这些疾病的特征包括几种罕见的良性和恶性肿瘤,如胸膜肺母细胞瘤、卵巢性索间质肿瘤、睫状体髓上皮瘤、鼻软骨间叶错构瘤、多结节性甲状腺肿/甲状腺滤泡性结节性疾病和分化型TCs等。最近的研究评估了儿童和成人甲状腺结节的DICER1突变,发现甲状腺疾病是DICER1突变最常见的表现。在一些携带DICER1突变的胸膜肺母细胞瘤患者接受化疗后发现分化型TC。婴儿期甲状腺滤泡性结节性疾病和分化型TCs是胚系DICER1突变或DICER1综合征的高度特异性表现。此外,PDTC和甲状腺母细胞瘤应引起对DICER1体细胞突变的关注。认识到这些表现应促使临床医师加快对这一肿瘤综合征的遗传学评估,并将这些患者归类为发生其他多器官恶性肿瘤的高危患者。DICER1突变必须在临床疾病负荷的背景下进行检测,因为本研究中出现的肿瘤体积小且缺乏血管侵犯,表现出惰性生物学行为。
NUT癌是一种罕见的鳞状细胞癌亚型,由编码NUT融合致癌蛋白(最常见的融合伴侣是BRD4)的NUTM1基因重排定义。仅有罕见的原发性NUT重排TC被报道。在本研究中,NSD3::NUTM1融合在2例原发性PDTC患者(1例有ATC成分)中被发现。肿瘤无鳞状分化(非NUT样形态),未见BRAF、RAS、RET、TP53和TERT突变。这些研究结果证实了之前的观察结果,即NUT癌可以模仿其他甲状腺原发灶,并且具有较高的NSD3::NUTM1融合率。最近的一项研究表明,与非甲状腺原发性NUT重排癌相比,临床病程较长,本研究中的1例患者在初次诊断后8个月死于该病。本研究结果提示,NUTM1融合可能发生于数量未知的TC,具有高级别形态和高分化的甲状腺细胞。病理学家应将NUT癌纳入任何低分化和未分化甲状腺恶性肿瘤的鉴别诊断。识别这一实体可能具有重要的预后意义。NUTM1融合的TCs可能适合NUT癌靶向治疗。由于NTRK融合基因在TC中的罕见发生,其数据非常有限。少数NTRK融合阳性癌的队列被描述和表征,包括与滤泡或滤泡和乳头生长模式混合、慢性淋巴细胞性甲状腺炎和淋巴结转移的相关性。与先前的观察一致,NTRK1重排癌比NTRK3重排癌表现出更高的侵袭性。
1例患者携带NTRK1重排,免疫组化显示PMS2蛋白表达缺失。对该肿瘤的测序研究未发现PMS2基因突变。对胚系PMS2突变的研究表明,PMS2通常可通过包含基因的很大一部分或整个外显子的大片段缺失发生突变。在该病例中进行的NGS检测无法检测到这些类型的缺失,并且尚不清楚该患者的肿瘤是否可能有免疫组织化学结果显示的导致PMS2蛋白缺失的其中一种变异。据研究者所知,在NTRK1::TPM3融合的PTC中,PMS2的缺失在以前没有报道过。尽管NTRK基因变异的甲状腺乳头状癌罕见,但考虑到NTRK特异性酪氨酸激酶抑制剂(如拉罗替尼和恩曲替尼)的高临床疗效,识别NTRK基因变异的病例很重要。在驱动TC肿瘤发生的基因融合领域,原癌基因RET的重排是PTC中最常见的变异。除了最常见的RET::CCDC6重排外,已有超过15个伴侣基因被报道。RET::PTC基因融合并不总是导致PTC。越来越多的证据表明,RET::PTC融合也在良性甲状腺疾病中表达,包括甲状腺腺瘤和桥本甲状腺炎。此外,其他研究表明RET::PTC重排与具有实性生长模式的嗜酸细胞癌显著相关。由于融合基因在高级别分化型TC中的罕见发生,其数据非常有限。仅5例进行了分子检测:1例为PAX8::PPARG;1例携带ARID1A、PIK3R1和RUNX1T1;1例携带TERT和PTEN外显子3突变;1例携带TERT和NRAS Q61R突变;1例携带CDKN2C、DAXX、NF1、PIK3CA、PPP2R1A、PTEN、RB1、p53多种突变。据研究者所知,在没有BRAF、RAS、TP53和TERT突变的高级别分化型TC中,RET::SPECC1L融合既往未见报道,考虑到RET特异性酪氨酸激酶抑制剂(如已被批准用于甲状腺癌的塞普替尼)可能靶向RET变异,因此应关注这一点。
在分析的样本中,在1例滤泡性PTC中发现了一个新的G3BP2::FGFR2融合转录本。FGFR2突变被广泛报道与乳腺癌和子宫内膜癌的风险增加相关,并且与DFS缩短显著相关。FGFR2融合基因在TC中的数据非常有限,因为它们很少发生。靶向FGFR是否会对这些病例产生临床益处尚不清楚,需要进一步的临床研究。
虽然手术仍然是可切除TC患者的首选治疗,但分化型转移性TC患者可能需要额外的化疗。在这些侵袭性较强的疾病中,对可干预的融合和突变进行分子检测很重要。如本病例队列所示,在被诊断为高级别滤泡源性TC的病例中,100%存在与较差预后相关的突变或融合,或与需要进一步研究的胚系综合征相关,或存在可干预的突变。在高级别滤泡源性TC患者的这一分子检测队列中观察到的高检出率提示,对这一人群进行更常规的分子检测将是一种有益的临床实践。由于这是一种罕见的实体,本研究仅纳入了5例,可能需要更多的临床资料。
NGS技术的应用提高了我们对TC分子遗传学的认识。本研究在PTC、PDTC和高级别分化型TC患者中发现了MLH1、MSH2、NSD3::NUTM1、RET::SPECC1L和G3BP2::FGFR2等罕见基因变异,这些变异增加了可与特定药物联合用于治疗的分子靶点,这些药物通常毒性较小,并且与未经选择的侵袭性TC的当前标准治疗相比,相似或更有效。
参考文献:
Alexiev BA, Vormittag-Nocito ER, Lorch J, Yeldandi A, Buttars PR, Jennings LJ. Uncommon molecular alterations in follicular-derived thyroid carcinoma: A single institution study. Pathol Res Pract. 2024;258:155355. doi:10.1016/j.prp.2024.155355

作者:苏州绘真医学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#甲状腺癌# #基因变异# #NGS#
11
认真学习了
9
签到学习
8