Nat Biothechnol:装上了迷你版PD-1抗体的CAR-T细胞,对抗实体瘤如鱼得水
2018-08-15 小博 医麦客
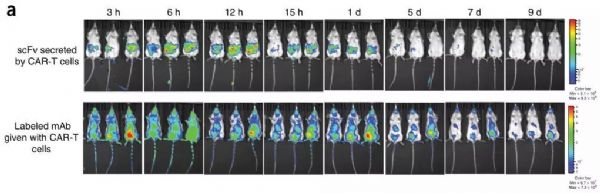
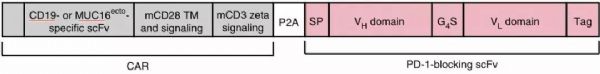
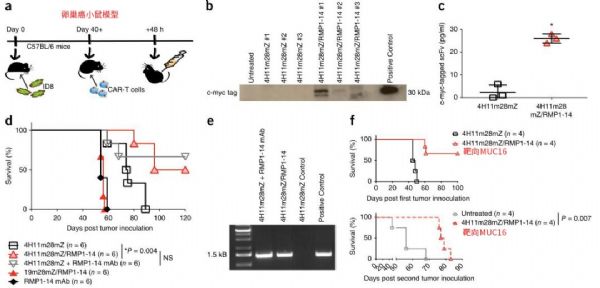
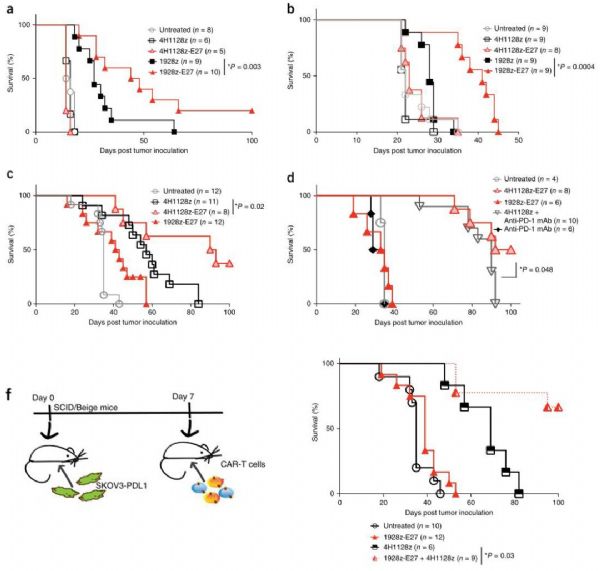
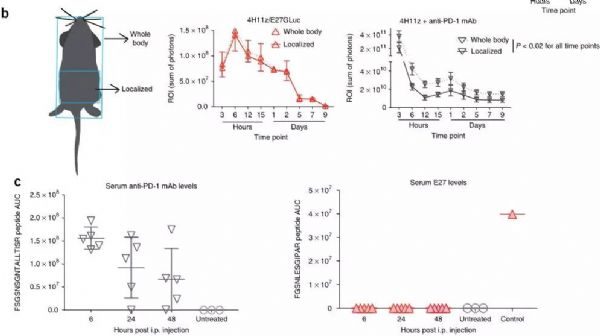
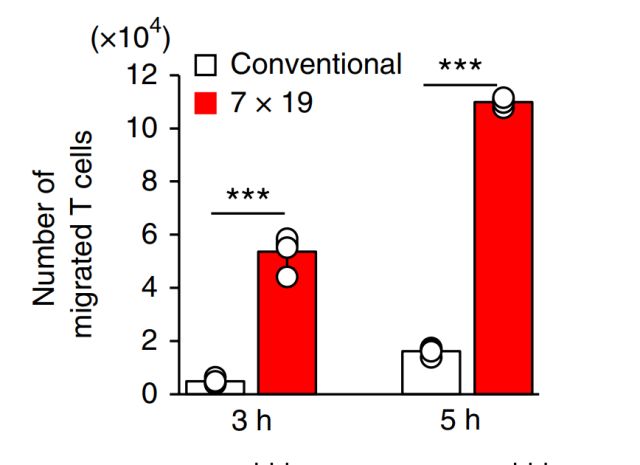
MSKCC(纪念斯隆凯特琳癌症中心)的科学家宣布他们已经建立了最新的工程化细胞,其具有强大的“装甲”战备,将两种最具潜力的免疫疗法——CAR-T细胞和检查点抑制剂组合在了一起,能够有效对抗实体瘤。

作者:小博
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#CAR-#
34
#Nat#
0
#Bio#
35
a:¥CnTwb1llNAq¥
65
#PD-1抗体#
39