J THORAC ONCOL:阿维鲁单抗与铂类双重化疗作为高表达PD-L1+转移性非小细胞肺癌患者的一线治疗:JAVELIN lung 100试验3期的初步分析
2023-10-11 daikun MedSci原创
该研究旨在评估阿维鲁单抗与铂类双重化疗作为高表达PD-L1+转移性非小细胞肺癌患者的一线治疗的疗效和安全性,与铂类双要化疗相比,阿维鲁单抗的中位OS和PFS更长,但OS和PFS的差异不具有统计学意义。
基于3期试验的结果,几种免疫检查点抑制剂(ICI)已被批准作为一线治疗晚期程序性死亡配体1阳性(PD-L1+)非小细胞肺癌(NSCLC)的单一疗法。在KEYNOTE-024试验之后,帕博利珠单抗(抗程序性死亡1(PD-1)抗体)成为美国和欧洲第一个针对高表达PD-L1+肿瘤(肿瘤比例评分[TPS]≥50%)且无靶向表皮生长因子受体(EGFR)或间变性淋巴瘤激酶(ALK)基因突变的晚期NSCLC患者的ICI。根据KEYNOTE-042试验,美国的批准扩大到PD-L1 TPS≥1%的患者,尽管亚组分析表明帕博利珠单抗与铂类化疗的优越疗效主要发生在TPS≥50%的PD-L1+亚组。在IMpower110和EMPOWER Lung 1试验中,分别使用阿替利珠单抗(抗PD-L1抗体)和西米普利单抗(抗PD-1抗体)单药治疗,在高表达PD-L1+肿瘤的患者中,与铂类化疗相比,总生存期(OS)更长,没有可行的驱动突变。其他几项3期临床试验显示,无论PD-L1状态如何,基于ICI的联合治疗与单独化疗作为NSCLC的一线治疗均具有优越的疗效。然而,对于高表达PD-L1+肿瘤患者的ICI单药治疗可以提供长期生存益处,而不会产生与联合方案相关的额外毒性负担。
阿维鲁单抗是一种人类抗PD-L1 IgG1抗体,在各国被批准作为转移性默克尔细胞癌的单一疗法,一线含铂化疗后晚期尿路上皮癌的单一疗法(无疾病进展患者的一线维持治疗或疾病进展患者的二线治疗),并与阿昔替尼联合用于晚期肾细胞癌的一线治疗。在第1b阶段。然而,对于高表达PD-L1+肿瘤患者的ICI单药治疗可以提供长期生存益处,而不会产生与联合方案相关的额外毒性负担。JAVELIN实体瘤试验队列中,阿维鲁单抗显示出抗肿瘤活性和可接受的安全性作为晚期NSCLC患者的一线治疗。在3期JAVELIN Lung 200试验中,阿维鲁单抗与多西紫杉醇相比并未显著延长铂类治疗PD-L1+NSCLC患者的OS;然而,事后分析显示,在PD-L1+肿瘤表达较高的亚组中,阿维鲁单抗的2年OS率增加了一倍。此外,在二线NSCLC环境中对阿维鲁单抗进行的初步药代动力学(PK)分析显示,更多的阿维鲁单抗暴露与更高的客观缓解率(ORR)之间可能存在关联。该研究报告了3期JAVELIN Lung 100试验的初步分析结果。

方法:JAVELIN Lung 100(NCT02576574)是一项3期开放标签多中心试验。符合条件的患者经组织学证实为可测量,转移或复发(IV期),PD-L1+的NSCLC。其他资格标准包括:年龄≥18岁;东部肿瘤协作组的表现状态(ECOG PS)为0或1;估计预期寿命>12周;以及足够的肝,肾和血液功能。如果患者先前接受过针对T细胞调节蛋白的抗体或药物或肺癌的全身治疗,则不符合条件。如果患者患有以下情况,则也不合格:携带EGFR突变的NSCLC;携带ALK重排的非鳞状NSCLC;具有任何其他可操作的分子突变的肿瘤。
患者最初以1:1的比例随机接受阿维鲁单抗 10 mg/kg每2周(Q2W)或铂类双联化疗。在2016年11月21日进行方案修订后,研究设计发生了变化,增加了第三组患者,这些患者每周接受一次 10 mg/kg(QW)治疗12周,随后接受阿维鲁单抗 10 mg/kg Q2W(QW组);此外,OS被添加为第二个主要终点。
1 人群和基线特征
在2015年10月至2018年10月期间,1214例PD-L1+肿瘤患者被随机分组,其中497例为高表达PD-L1+肿瘤患者。在所有随机患者和高PD-L1+人群中,治疗组之间的基线特征相似。
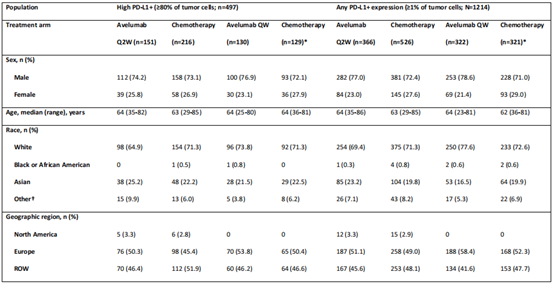
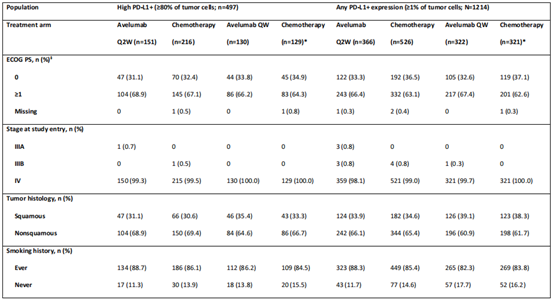
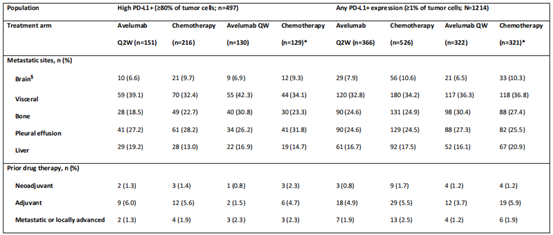
2 OS分析
在高PD-L1+人群中,阿维鲁单抗Q2W与化疗的中位随访时间分别为48.8个月(44.3-59.9)和45.6个月(43.6-57.1),阿维鲁单抗QW与化疗的中位随访时间分别为41.9个月(40.0-43.3)和42.8个月(40.6-43.8)。阿维鲁单抗与化疗相比观察到更长的OS,但差异无统计学意义。与化疗相比,阿维鲁单抗Q2W和QW的OS风险比(HR)分别为0.85(95%CI,0.67-1.09;单侧p=0.1032;显著性阈值,0.0019)和0.79(95%CI,0.59-1.07;单侧p=0.0630;显著性阈值,0.0057)。中位OS(95%置信区间)阿维鲁单抗Q2W与化疗相比为20.1个月(15.0-24.3)与14.9个月(11.8-18.6),阿维鲁单抗QW与化疗相比为19.3个月(14.0-28.1)与15.3个月(11.6-19.1)。
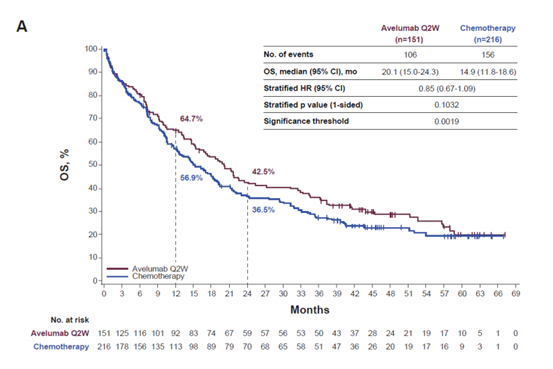

3 PFS分析
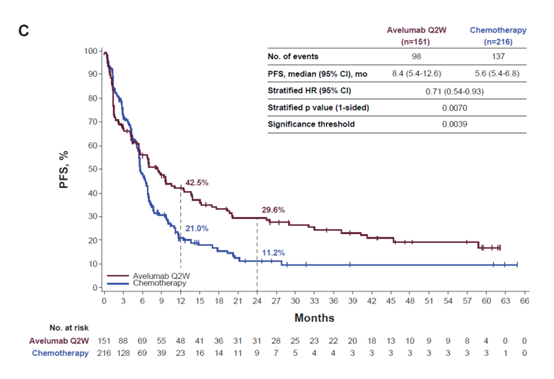
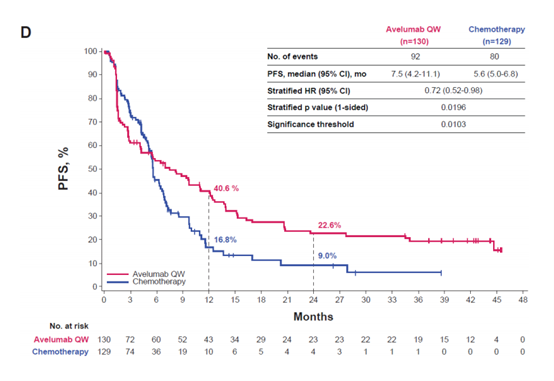
阿维鲁单抗与化疗相比也观察到更长的PFS,但同样,差异无统计学意义。与高PD-L1+人群的化疗相比,阿维鲁单抗Q2W和QW的PFS HR分别为0.71(95%CI,0.54-0.93;单侧p=0.0070;显著性阈值,0.0039)和0.72(95%CI,0.52-0.98;单侧p=0.0196;显着性阈值,0.0103)。阿维鲁单抗Q2W与化疗的中位PFS(95%CI)分别为8.4个月(5.4-12.6)和5.6个月(5.4-6.8),阿维鲁单抗QW与化疗的中位PFS(95%CI)分别为7.5个月(4.2-11.1)和5.6个月(5.0-6.8)。
4 安全性分析
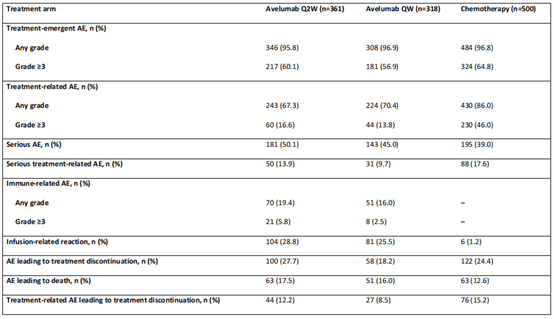
在阿维鲁单抗Q2W(n=361)、阿维鲁单抗QW(n=318)和化疗(n=500)组接受≥1剂研究治疗的患者中,346例(95.8%)、308例(96.9%)和484例(96.8%)患者发生了任何级别的治疗紧急不良事件(TEAE),其中≥3级217名(60.1%),181名(56.9%)和324名(64.8%)患者的TEAE。243例(67.3%)接受阿维鲁单抗Q2W治疗的患者,224例(70.4%)接受阿维鲁单抗QW治疗的患者和430例(86.0%)接受化疗的患者发生了任何级别的治疗相关不良事件(TRAEs),其中≥3级TRAEs分别为60例(16.6%),44例(13.8%)和230例(46.0%)。
结论:在晚期NSCLC中,与铂类双要化疗相比,阿维鲁单抗的中位OS和PFS更长,但OS和PFS的差异不具有统计学意义,且该试验未达到其主要目标。
原始出处:
Reck M, et al. 2023. Avelumab vs platinum-based doublet chemotherapy as first-line treatment for patients with high-expression PD-L1+ metastatic non-small cell lung cancer: primary analysis from the phase 3 JAVELIN Lung 100 trial. Journal of Thoracic Oncology.DOI: 10.1016/j.jtho.2023.09.1445.
作者:daikun
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








学习学习
49
眼界大开
57
很棒,通俗易懂
0
认真学习了
47