美国FDA宣布:全球第4款CAR-T细胞疗法获批上市,治疗复发性或难治性大B细胞淋巴瘤,安全性更高!
2021-02-07 MedSci原创 MedSci原创
2021年2月5日,美国食品和药物管理局(FDA)宣布批准百时美施贵宝(BMS)旗下Juno Therapeutics公司开发的Breyanzi(lisocabtagene maraleucel,
2021年2月5日,美国食品和药物管理局(FDA)宣布批准百时美施贵宝(BMS)旗下Juno Therapeutics公司开发的Breyanzi(lisocabtagene maraleucel,liso-cel),用于治疗复发性或难治性大B细胞淋巴瘤(R/R LBCL)成人患者,包括弥漫性大 B 细胞淋巴瘤(DLBCL),这些患者对至少2种其他全身性治疗没有应答,或者在治疗后复发。

https://www.fda.gov/news-events/press-announcements/fda-approves-new-treatment-adults-relapsed-or-refractory-large-b-cell-lymphoma
弥漫性大B细胞淋巴瘤(DLBCL)是一种最常见的发展迅速的侵袭性疾病,是非霍奇金淋巴瘤最常见形式,约占三分之二。73%的患者在二线治疗或更晚阶段无反应或复发。对于复发或对初始疗法无反应的患者,提供持续反应的常规治疗有限,中位预期寿命约为六个月。 与复发或难治的大型B细胞淋巴瘤作斗争的人们,无论是在身体还是情感上,都面临着艰巨的挑战。
Breyanzi是美国FDA批准的第3款靶向CD19的自体CAR-T细胞疗法,也是FDA批准的第4款CAR-T细胞疗法。截止目前,除了Breyanzi外,其他3款包括诺华的Kymriah和吉利德的Yescarta和Tecartus。在靶点选择上,Breyanzi与此前上市的3款CAR-T一样均为CD19,且适应症无差别。而在安全性和有效性上,比其他3款CAR-T细胞疗法相比,Breyanzi的独特之处在于良好的安全性数据,由于CD8阳性和CD4阳性T细胞的比例得到控制(1:1),Breyanzi从而能更好地控制细胞疗法的毒副作用。
Breyanzi的批准是基于一项TRANSCEND NHL 001临床试验,该研究在评估了超过250名患难治性或复发的大B细胞淋巴瘤患者,结果发现,使用单剂量Breyanzi治疗后的总缓解率(ORR)为73%、完全缓解率(CR)为54%,中位无进展生存期(PFS)为6.8个月、中位总生存期(OS)为21.1个月。病情获得完全缓解的患者中,中位PFS和OS尚未达到,在12个月时,有65.1%的患者病情没有进展、有85.5%的患者存活。
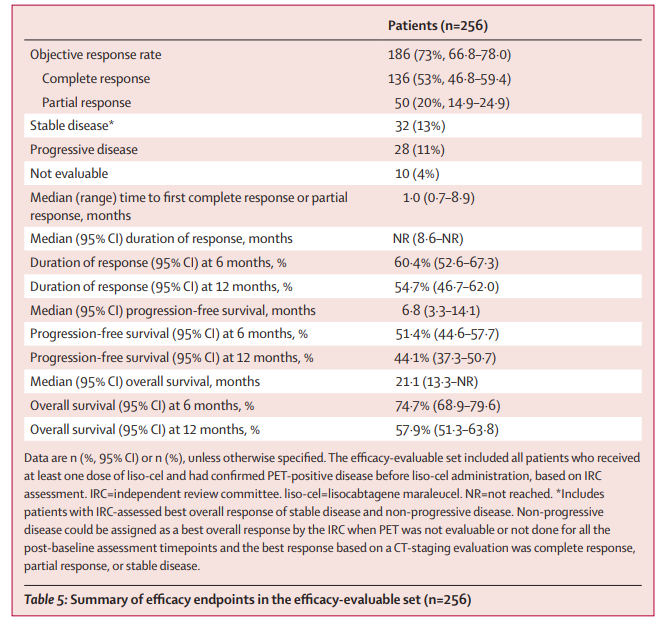
疗效终点汇总 doi:10.1016/s0140-6736(20)31366-0
在安全性方面的数据明显优于其他CAR-T疗法,在诱发细胞因子风暴上的概率更低。结果显示,46%的患者发生任何级别的细胞因子释放综合征(CRS),3级或更高级别的细胞因子释放综合征发生为2%。CRS的中位持续时间为5天(范围:1-30天),中位发病时间为5天(范围:1-15天)。CRS最常见的表现包括发烧(93%),低血压(49%),心动过速(39%),畏寒(28%)和缺氧(21%)。在接受Breyanzi治疗的患者中,35%发生了任何等级的神经毒性事件(NT)12%的患者出现3级以上的NT。在所有患者中,包括在死亡时或数据截止时具有持续神经系统事件的患者,神经系统毒性中位持续时间为15天。
由于严重甚至致死的细胞因子风暴以及神经毒性,FDA可能会对这款疗法发黑匣子警告。FDA制定了一项风险评估和缓解策略,要求使用该疗法的医疗机构和医生必须经过特殊认证。另外,在使用该疗法时,医生应告知在接受Breyanzi治疗后所出现的细胞因子释放综合征,神经系统毒性以及其他不良反应。为了进一步评估长期安全性,FDA还要求制造商进行上市后的观察性研究。
FDA授予Breyanzi孤儿药,再生医学先进疗法(RMAT)和突破疗法称号。RMAT认定是作为美国21世纪治愈法案的一部分于2016年12月被推出,旨在帮助促进严重疾病的再生医学疗法的快速发展,拥有RMAT称号可以加速生物科技公司的创新药物上市。Breyanzi是第一个获得RMAT认证的再生医学疗法,并获得了FDA的许可。
参考来源
1.https://www.fda.gov/news-events/press-announcements/fda-approves-new-treatment-adults-relapsed-or-refractory-large-b-cell-lymphoma
2.https://news.bms.com/news/corporate-financial/2021/U.S.-Food-and-Drug-Administration-Approves-Bristol-Myers-Squibbs-Breyanzi-lisocabtagene-maraleucel-a-New-CAR-T-Cell-Therapy-for-Adults-with-Relapsed-or-Refractory-Large-B-cell-Lymphoma/default.aspx
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言




#复发性#
19
#获批上市#
54
#CAR-#
19
#细胞淋巴瘤#
23
#B细胞#
36