eGastroenterology:胆汁酸在肝脏病理生理过程中调控细胞应激反应的机制
2024-06-15 eGastroenterology eGastroenterology
系统阐述胆汁酸失调和细胞应激反应的交互作用对慢性肝病的影响,希望能为胆汁酸作为诊断标志物以及开发基于胆汁酸的治疗措施提供新思路。
导读
胆汁酸对肝脏的病理生理过程至关重要,胆汁酸稳态失调会改变细胞功能,并导致慢性肝病中的细胞损伤。最近的研究发现胆汁酸信号传导与自噬和溶酶体生物学、氧化还原稳态和内质网应激调节之间的新联系,然而关于这种新联系的具体机制目前尚不清楚。为此,eGastroenterology特邀来自美国俄克拉荷马大学健康科学中心的Tiangang Li教授及其团队撰写相关综述,系统阐述胆汁酸失调和细胞应激反应的交互作用对慢性肝病的影响,希望能为胆汁酸作为诊断标志物以及开发基于胆汁酸的治疗措施提供新思路。

胆汁酸合成与肠肝循环
胆汁酸合成是肝细胞以胆固醇为底物的涉及许多酶反应的复杂过程,具体可分为两种途径(见图1):
(1) 经典途径:胆固醇首先在胆固醇7α-羟化酶(CYP7A1)的介导下发生7α羟基化。其中,CYP7A1是该途径中的限速酶,其表达受到胆汁酸反馈抑制。在人类和许多非人类灵长类动物中,经典途径主要合成两种胆汁酸:鹅脱氧胆酸(chenodeoxycholic acid,CDCA)和胆酸(cholic acid,CA)。
(2) 替代途径(酸性途径):胆固醇首先在C-27位置被线粒体酶固醇27-羟化酶(CYP27A1)羟基化,生成27-羟基胆固醇。替代途径的主要产物是CDCA。
在这两种途径中,胆汁酸合成中间产物都会经历侧链缩短,生成24碳胆汁酸分子。在人类中,两种主要的胆汁酸CDCA和CA约占胆汁酸总量的80%。新合成的胆汁酸在肝细胞中与两种氨基酸之一(甘氨酸或牛磺酸)有效地结合。因此,未结合胆汁酸在胆道中的胆汁酸中占比通常很小。在人类中,甘氨酸结合物与牛磺酸结合物的比例大约为3:1。相比之下,小鼠几乎仅使用牛磺酸与胆汁酸结合,只留下极少的甘氨酸结合物,其生理意义可能可忽略不计。
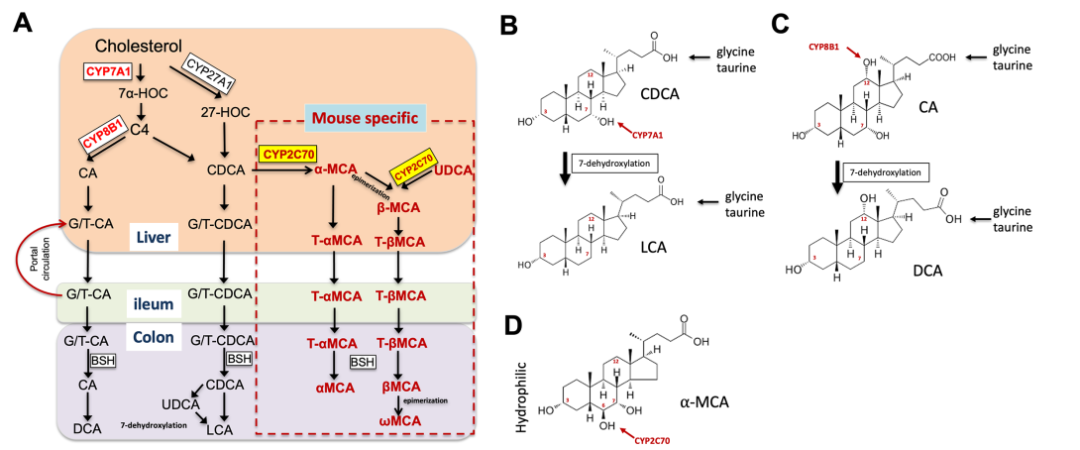
图1:胆汁酸合成的物种差异。(A)胆汁酸的经典合成途径与替代合成途径;(B–D)初级和次级胆汁酸的结构。
来源:原文图1
胆汁酸在肝脏和肠道之间循环,这一过程被称为胆汁酸的肠肝循环(见图2)。在肝细胞中,胆汁盐输出泵(BSEP,ABCB11)介导胆汁酸分泌到胆小管中。胆汁中的胆汁酸与胆固醇和磷脂形成胶束,这一过程对于防止胆固醇沉淀和游离胆汁酸对胆管上皮细胞的损伤至关重要。胆汁酸释放到小肠后,主要通过肠上皮细胞顶端的钠-胆汁酸转运体(apical sodium-bile acid transporter,ASBT)在回肠末端被高效吸收,超过90%的胆汁酸在回肠末端被重新吸收并通过门静脉循环返回肝脏。此外,肝细胞基底外侧胆汁酸摄取由牛磺酸钠共转运多肽(Na+-dependent taurocholate co-transporting polypeptide,NTCP)和有机阴离子转运多肽同工型介导。通过这些反应,初级胆汁酸 CA 被转化为脱氧胆酸(deoxycholic acid,DCA),而 CDCA则被转化为石胆酸(lithocholic acid,LCA)或熊脱氧胆酸(ursodeoxycholic acid,UDCA)。部分次级胆汁酸在大肠中被被动吸收,运输到肝脏进行结合,而其余大部分则被排泄到粪便中。因此,由于细菌 BSHs 的有效解离作用,大肠和粪便胆汁酸主要以未结合形式存在。
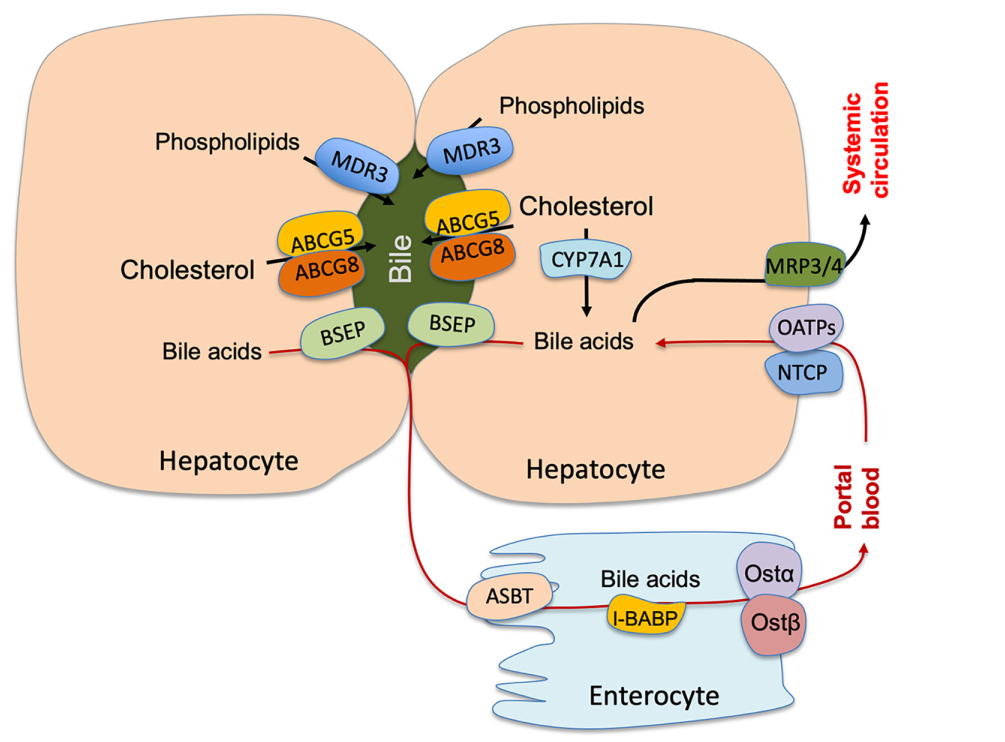
图2:胆汁酸在肠肝循环中的转运。
来源:原文图2
胆汁酸与自噬-溶酶体信号通路的交互作用
自噬是一种依赖溶酶体的细胞降解途径(见图3)。在这个过程中,自噬体(双膜囊泡)通过囊泡融合将内容物吞噬并运输到内体/溶酶体,随后自噬底物被溶酶体酶降解。自噬通常被认为是一种细胞保护机制,因为它介导了陈旧蛋白质和受损细胞器的转运,有助于维持细胞完整性。此外,自噬还被认为是细胞分解代谢的一部分,并通过降解宏量营养素发挥作用。因此,细胞能量状态对大多数细胞的自噬活性有重大影响。自噬是在营养缺乏和禁食的情况下诱发的,并在能量过剩时被抑制。雷帕霉素的机制靶标(mechanistic target of rapamycin,mTOR)是自噬活性最强的抑制剂之一,它在细胞营养物质丰富和细胞外营养/生长因子存在时被激活;相反,在营养物质稀缺的情况下,是AMPK通路的激活促进了自噬。
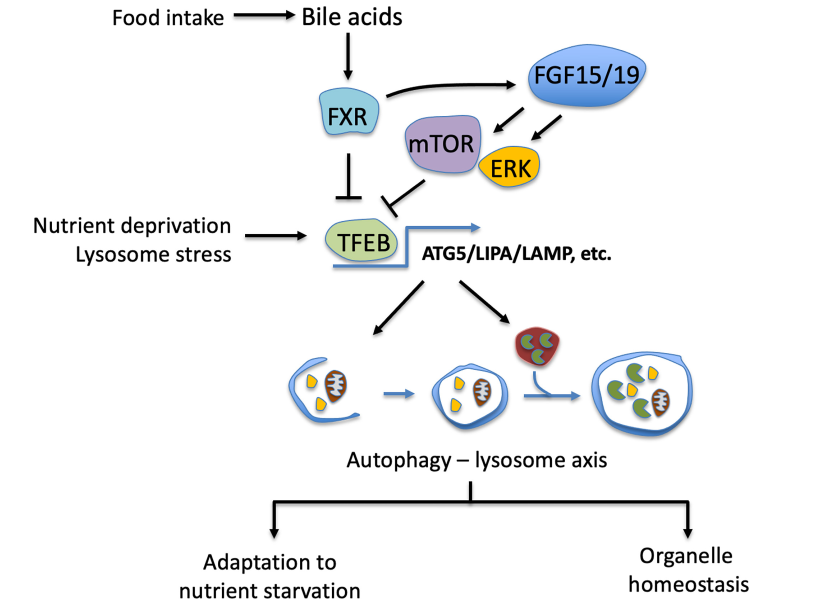
图3:胆汁酸对自噬-溶酶体轴的调节。
来源:原文图3
据报道,包括胆汁淤积和脂肪肝在内的许多慢性肝病都存在自噬受损的情况。肝脏自噬基因Atg5或Atg7缺失的小鼠缺乏肝脏自噬活性,并出现肝脏损伤,伴有肝脏和血液中胆汁酸升高、胆管反应和FXR活性受损,且受损的肝脏自噬可能促进胆汁淤积中的肝脏损伤。尽管胆汁酸和自噬交互作用的机制尚未完全清晰,但过去几年的研究已经揭示了胆汁酸信号调节肝脏自噬活性的机制。在人类和小鼠中,餐后状态下循环胆汁酸和FGF15/19迅速增加。有研究表明,餐后胆汁酸水平的升高与其他内分泌激素(如胰岛素)协同作用,以调节肝脏代谢,包括抑制肝脏葡萄糖的产生和刺激肝脏蛋白质的合成。相应地,胆汁酸激活的FXR(farnesoid X receptor)和胆汁酸诱导的FGF15/19均已被证明可抑制肝脏中糖异生基因的表达,胆汁酸激活的FXR还被证明可以抑制自噬基因的表达,从而导致细胞自噬通量减少。转录因子EB(transcription factor EB,TFEB)已被证明是参与自噬和溶酶体发生基因的主要诱导剂,在禁食或饥饿期间,TFEB去磷酸化,随后转移到细胞核中以转录诱导一系列基因,促进自噬通量和溶酶体发生。同样地,氨基酸饥饿导致mTOR失活,从而引起TFEB核转移。在溶酶体应激/受损的情况下,TFEB也会被激活,以促进细胞溶酶体发生适应性反应。综上所述,新的研究揭示了胆汁酸激活的细胞途径如何抑制肝细胞中的自噬活性。从生理学角度来看,胆汁酸和FGF15/19对肝脏自噬的调节与自噬作为细胞分解代谢一部分维持细胞能量稳态的细胞功能是一致的。然而,胆汁酸在胆汁淤积期间抑制自噬会导致在存在细胞器损伤时出现细胞不适应,从而促进肝损伤。
胆汁酸与内质网应激的交互作用
内质网功能受损会导致未折叠或错误折叠的蛋白质积累,这是一种被称为内质网应激的细胞状态。作为对蛋白质错误折叠和内质网应激的响应,细胞会激活未折叠蛋白反应(unfolded protein response ,UPR),该反应由内质网应激感受器组成。这些内质网应激感受器通过减少内质网蛋白质错误折叠和从头蛋白质合成来激活细胞对内质网应激的适应性,以维持细胞完整性和存活。然而,长期未解决的内质网应激最终会导致细胞周期停滞和凋亡,这部分由UPR信号级联介导。据报道,胆汁淤积与升高的内质网应激标志物相关:用高浓度的疏水胆汁酸处理肝细胞会导致内质网应激,亲水胆汁酸UDCA能够缓解化学物质诱导的肝细胞内质网应激。由于肝脏内质网应激缓解能力受损,缺乏XBP1的小鼠更易受到胆汁酸肝毒性的影响。这些发现表明,胆汁酸诱导的内质网应激在胆汁淤积期间的肝细胞损伤和死亡中发挥作用。然而,高浓度胆汁酸损害内质网功能并导致肝细胞内质网应激的机制仍不完全清楚,有待进一步阐明。
胆汁酸的肝毒性与胆汁淤积症
胆汁淤积定义为胆汁流出受阻致肝脏受损的任何病理状态。高浓度的疏水胆汁酸会导致体外肝细胞坏死,胆汁淤积的啮齿动物模型和人类胆汁淤积患者均表现出肝细胞坏死的组织学特征。由于疏水胆汁酸的洗涤剂特性,胆汁淤积条件下常见的高浓度胆汁酸可通过溶解质膜脂质和损害膜蛋白功能来破坏质膜完整性。即使胆汁流动没有受阻,胆汁酸的洗涤剂特性也需要通过与磷脂和胆固醇形成混合胶束来降低其与胆管上皮细胞的直接相互作用。此外,高浓度的胆汁酸已被证明会导致线粒体功能障碍和细胞ATP耗竭,进而导致肝细胞坏死。
胆汁酸还会导致培养肝细胞中的细胞凋亡。一些研究表明,疏水胆汁酸的促凋亡作用可能是通过激活细胞内应激激酶来实现,然而胆汁酸促进凋亡的机制尚不完全清楚。S1PR2的激活会导致JNK、AKT和ERK信号在细胞内的激活,这些信号已被证明可以促进胆管细胞的增殖,并涉及胆管癌。胆汁酸激活S1PR2也涉及胆汁酸诱导的肝细胞凋亡。TGR5不在肝细胞中表达,但在肝脏的胆管细胞和Kupffer细胞中高水平表达。TGR5的激活可以促进胆管细胞的增殖并保护肝细胞免受胆汁酸的毒性。Kupffer细胞中的TGR5在胆汁淤积中也起到抗炎作用。最近,新的证据表明胆汁淤积和胆汁酸诱导的细胞死亡也可能与细胞坏死性凋亡有关。尽管在胆汁淤积的人类肝脏和实验性小鼠肝脏中都检测到了不同类型的细胞死亡标志物,但胆汁酸对肝细胞的直接毒性主要在培养的肝细胞中得到证实。高浓度胆汁酸介导的肝细胞死亡可能触发初始肝损伤,但直接胆汁酸诱导的肝细胞死亡在慢性胆汁淤积中的相对贡献尚不清楚。这主要是因为所有形式的胆汁淤积都与炎症浸润有关。死亡或受损的肝细胞释放趋化因子和损伤相关分子模式分子,从而促进炎症。这些发现表明,胆汁淤积中胆汁酸依赖的细胞损伤涉及多种直接和间接机制,如果不解决潜在的胆汁酸毒性,仅针对细胞死亡途径的干预不太可能有效减缓胆汁淤积的进展。
胆汁酸肝毒性与代谢异常脂肪性肝病(MASLD)和酒精性肝病(ALD)
有研究表明,在MASLD(metabolic dysfunction-associated steatotic liver disease)和ALD(alcohol-associated liver disease)患者以及相关动物模型中均存在胆汁酸代谢的改变。与胆汁淤积相比,胆汁酸在MASLD和ALD发病机制中的作用远未明确。胆汁酸通过激活FXR和TGR5信号来改善脂质和葡萄糖稳态、胰岛素敏感性和炎症,突出了胆汁酸在正常生理条件下维持代谢稳态的关键作用,这为开发用于治疗MASLD的FXR和TGR5激动剂提供了分子基础。
据报道,在代谢相关脂肪性肝炎(MASH)、酒精性肝炎和病毒性肝炎中均存在胆汁酸诱导的肝胆损伤的组织学表现。慢性炎症可能促进肝胆功能障碍,使肝细胞和胆管上皮细胞更容易受到胆汁酸毒性的影响。然而,MASLD肝脏中这些肝胆汁酸变化的其他潜在分子机制仍未明确。特别是,尚未确定增加的循环胆汁酸是否是由于肠肝循环中总胆汁酸池的增加、肠道胆汁酸吸收的改变、肝脏窦状隙基底外侧胆汁酸摄取的减少或由于MASLD中胆汁胆汁酸分泌受损导致的基底外侧胆汁酸流出所致。由于人类胆汁酸池更具疏水性,肝内胆汁酸滞留可能具有更严重的影响。因此,胆汁淤积中胆汁酸毒性的许多致病机制也可能与MASLD相关。ALD患者中也发现了循环胆汁酸的升高,血清胆汁酸水平与ALD的严重程度呈正相关,这表明肝损伤可能是血清胆汁酸升高的潜在原因。然而,迄今为止尚未在人类临床试验中测试胆汁酸靶向药物在ALD中的疗效。与胆汁淤积不同,胆汁酸毒性不是MASLD和ALD的主要致病原因,但在肝脏维持胆汁酸稳态的能力受损的晚期疾病阶段,减少肝脏胆汁酸负荷的治疗方法可能具有额外的益处。
总结
最近的研究发现了胆汁酸信号与细胞应激反应和适应性机制的调节之间的交互作用,这极大地提高了我们对胆汁酸在肝脏生理和疾病中作用的认识。在胆汁淤积中,无论病因如何,降低胆汁酸介导的肝胆毒性仍然是主要的治疗目标。新的证据表明,胆汁酸肝毒性也可能导致MASLD和ALD的疾病进展。未来针对胆汁酸在细胞和分子水平上的作用进行的研究将帮助我们更全面地了解胆汁酸的功能,这将有助于确定胆汁酸在疾病发病机制中的作用、将胆汁酸作为潜在的诊断标志物以及开发基于胆汁酸的药理学干预措施。
引证本文
Tiangang Li, Mohammad Nazmul Hasan, Lijie Gu - Bile acids regulation of cellular stress responses in liver physiology and diseases: eGastroenterology 2024;2:e100074.
https://egastroenterology.bmj.com/content/2/2/e100074
作者:eGastroenterology
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#胆汁酸# #细胞应激反应#
62