《细胞》子刊:内外夹击,效果更强!科学家揭示PD-1和TIGIT共同阻断疗法的抗癌机制,共同为CD226解围来激活T细胞抗癌功能
2022-03-30 奇点网 奇点网
研究发现,查点蛋白PD-1和TIGIT共同调节共刺激性受体CD226的活性,从而调控T细胞的抗肿瘤免疫功能。而且在临床研究中观察到,CD226的表达水平与PD-L1抑制剂治疗NSCLC的临床效益相关。
目前在肿瘤治疗领域,以PD-1/L1抑制剂为代表的免疫检查点抑制剂已经取得前所未有的效果。
为了弥补单药治疗的不足,科学家们仍在不断寻找新的靶点以及联合治疗的最佳拍档,比如TIGIT、TIM-3、LAG-3等新兴免疫检查点。
与单打独斗相比,携手作战的效果确实不凡,联合治疗时常出现1+1>2的效果。
就在去年,一项2期临床试验(CITYSCAPE II)数据公布,PD-L1抑制剂(阿替利珠单抗)+TIGIT抑制剂(Tiragolumab)的联合治疗在一线治疗PD-L1阳性转移性非小细胞肺癌(NSCLC)时表现良好。与PD-L1抑制剂单药治疗相比,联合治疗的客观缓解率(ORR)显著提高(37% vs 21%)、中位无进展生存期(PFS)延长(5.6 vs 3.9个月)[1]。
不过,虽说联合治疗的临床效果已经很有排面了,但要问其中的协同机制还是一头雾水。
近日,一篇发表在Immunity期刊上的文章,揭示了免疫检查点蛋白PD-1和TIGIT共同阻断疗法的抗癌机制[2]。
来自美国基因泰克公司(Genentech)的Eugene Y. Chiang和Ira Mellman带领他们的团队发现,PD-1/PD-L1抑制剂的疗效与CD226的表达水平相关。免疫检查点PD-1和TIGIT分别从胞内和胞外调节CD226的活性,从而调控T细胞的抗肿瘤免疫功能。要想获得由CD226介导的最佳T细胞抗肿瘤细胞功能,需要同时阻断PD-1和TIGIT。

论文首页截图
在多种肿瘤模型中,都发现肿瘤内TIGIT表达增多的现象,并且与较差的预后有关。TIGIT和CD226之间的关系,与大家更为熟知的CTLA-4和CD28这对组合差不多——共同的配体,竞争的关系[3,4]。
TIGIT是在T细胞、NK细胞上广泛表达的一种共抑制性受体,当TIGIT与肿瘤细胞上的配体PVR/PVRL2结合时,通过信号通路传导,抑制CD8+T细胞或NK细胞的免疫杀伤活性,从而促使肿瘤细胞逃逸。
CD226则是受TIGIT调节的共刺激性受体,其配体也是PVR/PVRL2,与之结合后会诱导免疫激活。而TIGIT正是通过“抢”配体来阻断CD226介导的信号通路的。
不过有研究表明,借助CD226来发挥作用的免疫检查点蛋白,似乎不止是TIGIT,或许还有PD-1。
为证明这一想法,Eugene Y. Chiang和Ira Mellman和他们的团队先是对结直肠癌(CT26细胞系)小鼠模型进行了观察。
结果发现,患有结直肠癌的野生型小鼠,在使用TIGIT抑制剂或是PD-1抑制剂单药治疗后,肿瘤生长都能得到抑制。而对于患有结直肠癌的CD226缺失型(Cd226-/-)小鼠来说,TIGIT抑制剂不起效就算了(p<0.0001),PD-1抑制剂单药治疗的疗效竟然也会锐减(p<0.0001)。
另外,不管是CD226缺失,还是PVR/PVRL2缺失,都会导致CD8+ T细胞的细胞毒性降低,且效果相近。
这说明,PD-1和TIGIT或都是通过调控CD226及其配体PVR /PVRL2这条信号通路,来调节CD8+T细胞的抗肿瘤免疫反应的。
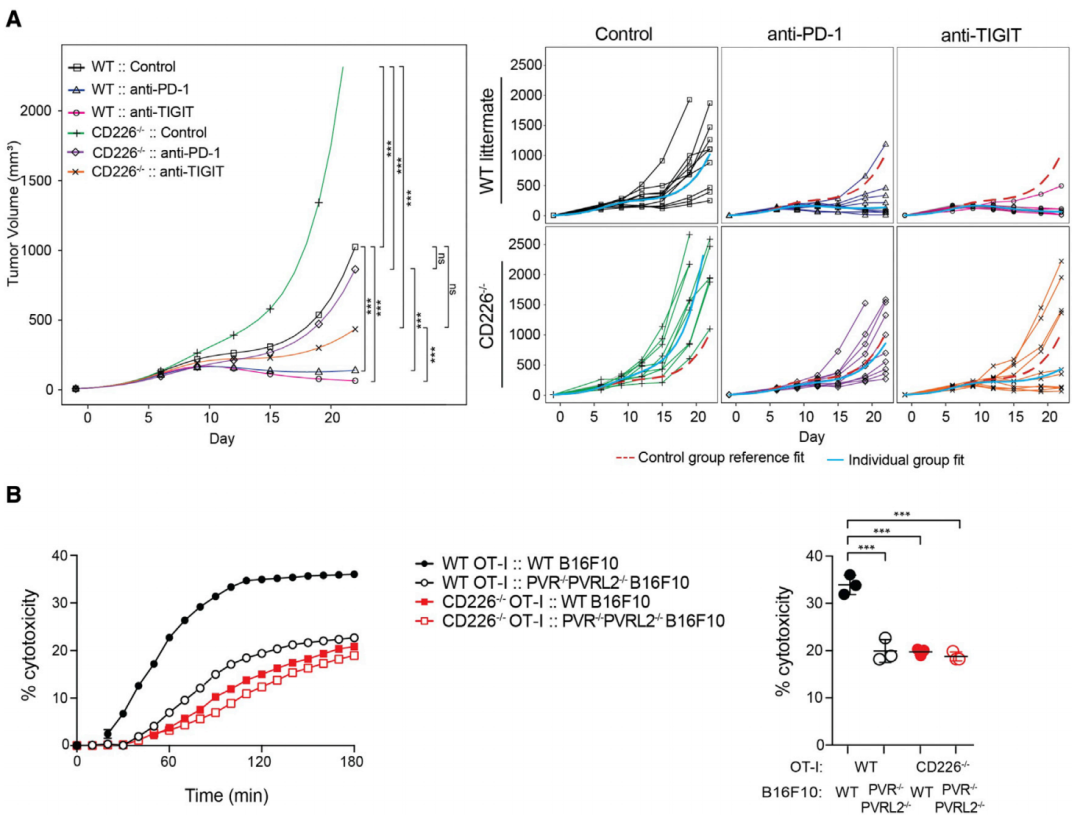
PD-1或能通过调控CD226来调节T细胞毒性
不仅如此,研究者们还对PD-L1抑制剂(阿替利珠单抗)治疗NSCLC的三项临床试验(BIRCH,OAK,POPLAR[5-7])数据进行分析。
结果显示,在这三项临床试验中,编码CD226的基因表达水平与患者的总生存期、无进展生存期的改善程度呈正相关。而编码CD28、PD-1和TIGIT等免疫检查点蛋白的基因表达水平,与这些临床效益相关性不显著。
这再次验证,CD226确实在PD-1/PD-L1抑制剂的免疫治疗反应中具有独特意义。
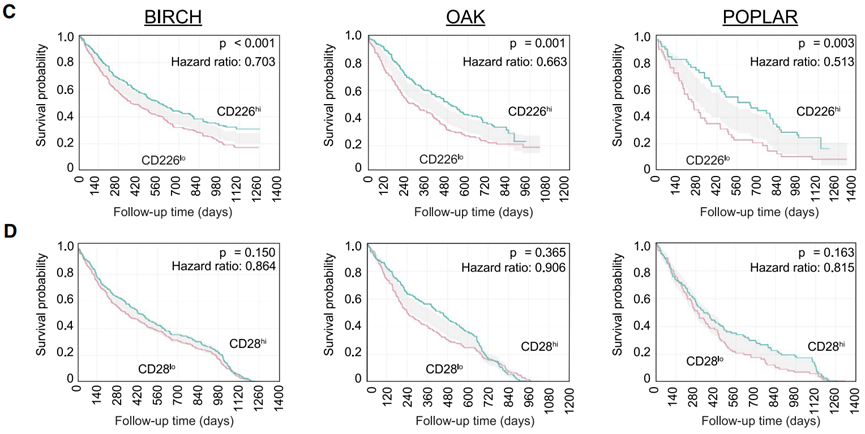
PD-L1抑制剂疗效好不好,可以看CD226?
值得注意的是,刚才提到的T细胞共刺激性受体CD28,已被证明是PD-1抑制剂的“有力搭档”,PD-1能够通过灭活CD28信号来抑制T细胞的抗肿瘤免疫功能[8]。
于是,研究者们使用质谱流式细胞技术(CyTOF),分析了NSCLC 患者的肿瘤组织样本中表达CD226和CD28的T细胞的表型特征。
分析结果显示,在NSCLC肿瘤中很少有浸润T细胞同时表达CD28和CD226(CD28+CD226+)。
这些在肿瘤中稀缺的CD28+CD226+ T细胞,一方面都高表达CD27,这是抗原特异性扩增和记忆T细胞早期发育的标志物;另一方面,T细胞衰竭的标志物TIM-3、组织驻留记忆T细胞(Trm)的标志物CD103表达水平都较低。
接下来,研究者们进一步使用scRNAseq分析和对比NSCLC患者的肿瘤和邻近健康组织的T 细胞表型。
结果发现,无论是在肿瘤组织还是在健康组织中,同时高表达CD28和CD226的T细胞都是处于正在增殖的状态或是具有记忆细胞毒性(标志物分别为Mitosis和KLRB1)。
也就是说,要想知道在NSCLC肿瘤中,哪个浸润T细胞有活力、有干劲儿,能够增殖和活化,可以看看它有没有同时表达CD28和CD226。
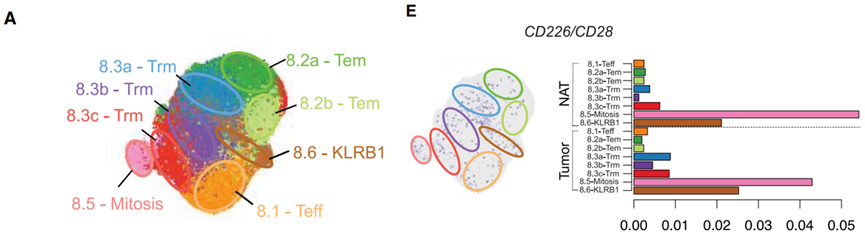
NSCLC肿瘤组织中的T细胞表型,CD28+CD226+ T细胞都表达Mitosis和KLRB1
从具体机制上看,PD-1和TIGIT分别从胞内和胞外对CD226进行“围剿”。
PD-1与PD-L1互作后, PD-1通过胞内结构域抑制CD226的磷酸化。TIGIT则是通过阻断与CD226的共同配体PVR /PVRL2的互作,来限制CD226的活化作用。
这样一来,当同时使用PD-1/PD-L1抑制剂和TIGIT抑制剂时,CD226信号通路的两把锁都会打开、完全恢复,此时CD8+ T细胞的抗肿瘤免疫功能得以放大。
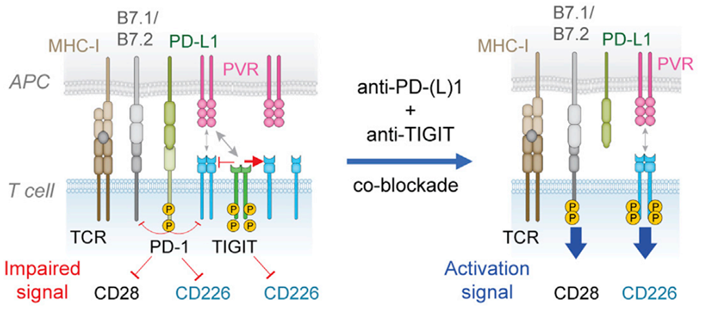
左:PD-1胞内抑制CD28和CD226的活性,TIGIT主要通过胞外竞争配体来抑制CD226的活性
右:同时抑制PD-1和TIGIT时,CD226“解围”
总体来说,Eugene Y. Chiang和Ira Mellman带领他们的团队发现,免疫检查点蛋白PD-1和TIGIT共同调节共刺激性受体CD226的活性,从而调控T细胞的抗肿瘤免疫功能。而且在临床研究中观察到,CD226的表达水平与PD-L1抑制剂治疗NSCLC的临床效益相关。
这项研究为免疫检查点阻断疗法的机制研究和临床应用提供了新的见解和策略。研究者们也表示,没想到PD-1和TIGIT介导的信号通路之间竟有如此密切的“合作关系”,而CD226或许可以作为预测PD-1/PD-L1抑制剂治疗效果的重要指标。
参考文献:
[1]https://www.roche.com/media/releases/med-cor-2021-01-05
[2]https://www.cell.com/immunity/fulltext/S1074-7613(22)00085-1?#%20
[3]Harjunpää H, Guillerey C. TIGIT as an emerging immune checkpoint. Clin Exp Immunol. 2020 May;200(2):108-119. doi: 10.1111/cei.13407. Epub 2019 Dec 25. PMID: 31828774; PMCID: PMC7160651.
[4]Manieri NA, Chiang EY, Grogan JL. TIGIT: A Key Inhibitor of the Cancer Immunity Cycle. Trends Immunol. 2017 Jan;38(1):20-28. doi: 10.1016/j.it.2016.10.002. Epub 2016 Oct 25. PMID: 27793572.
[5]Peters S, et al. Phase II Trial of Atezolizumab As First-Line or Subsequent Therapy for Patients With Programmed Death-Ligand 1-Selected Advanced Non-Small-Cell Lung Cancer (BIRCH). J Clin Oncol. 2017 Aug 20;35(24):2781-2789. doi: 10.1200/JCO.2016.71.9476. Epub 2017 Jun 13. Erratum in: J Clin Oncol. 2018 Mar 20;36(9):931.
[6]Rittmeyer A, et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. Lancet. 2017 Jan 21;389(10066):255-265. doi: 10.1016/S0140-6736(16)32517-X. Epub 2016 Dec 13. Erratum in: Lancet. 2017 Apr 8;389(10077):e5.
[7]Fehrenbacher L, et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet. 2016 Apr 30;387(10030):1837-46. doi: 10.1016/S0140-6736(16)00587-0. Epub 2016 Mar 10.
[8]Hui E, et al. T cell costimulatory receptor CD28 is a primary target for PD-1-mediated inhibition. Science. 2017 Mar 31;355(6332):1428-1433. doi: 10.1126/science.aaf1292. Epub 2017 Mar 9. PMID: 28280247; PMCID: PMC6286077.
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#阻断#
62
#阻断疗法#
41