Nature:科学家找到让癌细胞“消停”的关键——TRIM37或是细胞分裂的“变阻器”
2020-09-13 探索菌 生物探索
人体内时刻有细胞在分裂,在这个过程中出现的不受控制的错误会助长遗传错误,并可能继续发展为癌细胞。自100多年前癌细胞被发现以来,科学家们一直尝试寻找能够消灭这些“有害”细胞、治愈癌症的方法。
人体内时刻有细胞在分裂,在这个过程中出现的不受控制的错误会助长遗传错误,并可能继续发展为癌细胞。自100多年前癌细胞被发现以来,科学家们一直尝试寻找能够消灭这些“有害”细胞、治愈癌症的方法。
近日,顶级期刊《Nature》发表了两篇关于癌症治疗的重磅文章。在本条推文中,小编与大家分享第一篇——由牛津大学及约翰?霍普金斯大学的科学家们带来的一篇题为Targeting TRIM37-driven centrosome dysfunction in 17q23-amplified breast cancer的文章:通过选择性攻击细胞分裂机制的核心来杀死某些人类乳腺癌细胞,为我们寻找消灭癌细胞却又不伤害健康细胞的药物带来新的启发。
该报告的通讯作者之一、约翰?霍普金斯大学医学院分子生物学和遗传学副教授Andrew Holland博士说:“一些广泛使用的抗癌药物已经杀死了快速分裂的细胞,但是这些药物都有明显的缺点,在杀死癌细胞的同时也会有损健康细胞。”
关键在于,如何在保护健康细胞的同时,摧毁癌细胞?由于哺乳动物细胞分裂的过程相似,长期以来,Holland所在的研究团队一直尝试从癌细胞特有的细胞分裂机制找到突破口。
中心体是动物细胞中一种重要的细胞器,也是细胞分裂时内部活动的中心。尽管一些癌细胞能够在没有中心体的情况下增殖,但是研究人员发现存在一系列人乳腺癌细胞(MCF-7),它们非常依赖于中心体来进行细胞分裂和生存。
在这项研究中,研究人员发现,中心体依赖性的乳腺癌细胞含有17q23乳腺癌扩增子,这是一种在大约9%的乳腺癌细胞中发现的3-4-Mb的重复拷贝数异常。研究人员从17q23扩增子内的大约40个蛋白质编码基因中筛选出了TRIM37,该基因此前曾被报道过与中心体功能相关,敲除这一基因将导致无中心粒细胞中心体周围物质(PCM)的积累和纺锤体的加速组装。
先前的研究表明,蛋白激酶PLK4是阻断侵袭性乳腺癌细胞增长的靶标,PLK4抑制剂能够破坏构成中心蛋白的蛋白质,导致中心体衰竭。研究人员将PLK4抑制剂添加到在实验室中生长的、TRIM37水平正常的乳腺癌细胞中,发现即使去除了癌细胞的中心体,它们仍然可以分裂。但是如果把PLK4抑制剂添加到高TRIM37水平的乳腺癌细胞中,大多数细胞将停止生长或死亡。这说明TRIM37表达的增加在PLK4的抑制下是合成致死的。
随后的实验也验证了这一点,并进一步表明,PLK4(而非其他激酶)的抑制剂选择性在过表达TRIM37细胞的合成致死作用方面起着关键作用。
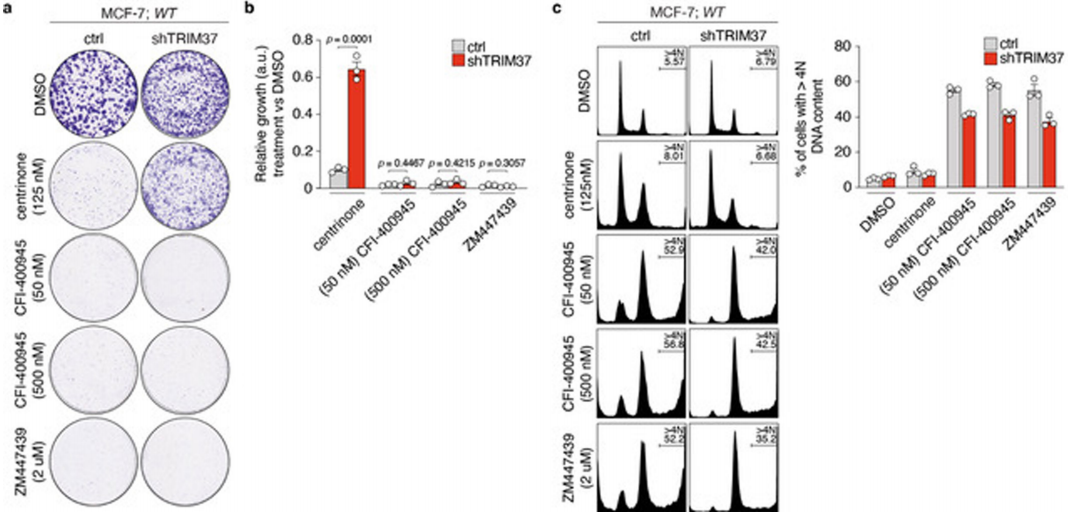
PLK4抑制剂选择性而非其他激酶是合成致死杀死过度表达TRIM37细胞所必需的
为了研究PLK4抑制如何触发MCF-7细胞的生长缺陷,研究人员使用延时显微镜跟踪了使用与未使用PLK4抑制剂的癌细胞的生长情况。结果发现,在中心体缺失的情况下,TRIM37是中心体周围物质的负调节因子,TRIM37表达的增加影响了纺锤体的组装,导致有丝分裂突变。
进一步分析表明,TRIM37过表达抑制非中心体型PCM灶点的形成,这些灶点具有微管成核能力,是缺少中心体的细胞分裂成功的必备结构。
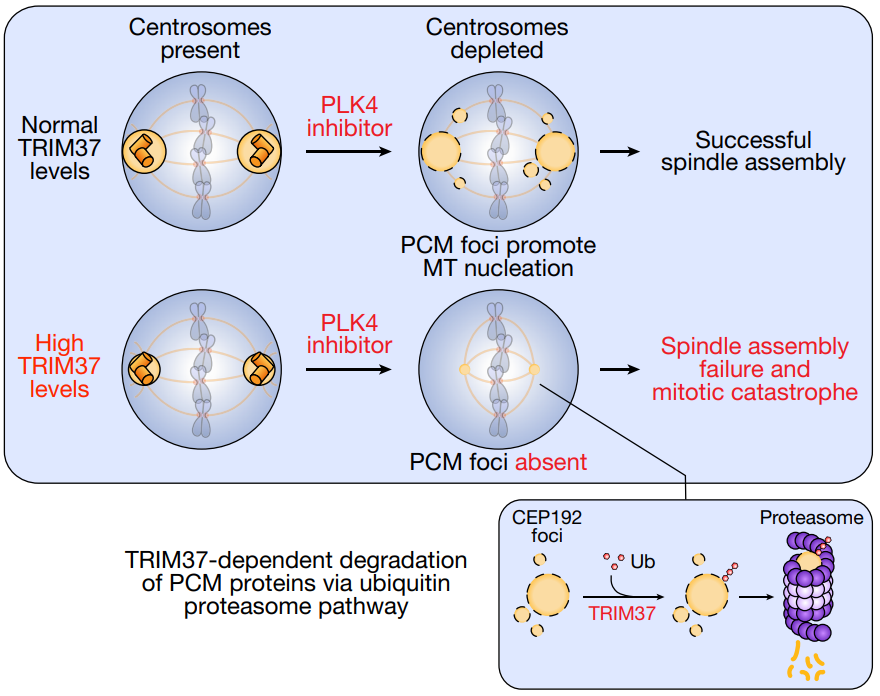
在17q23扩增的乳腺癌细胞中表达TRIM37抑制PLK4合成致死效应的模型
最后,研究人员还发现,TRIM37的过度表达通过延迟中心体成熟和在进入有丝分裂时加快中心体的分离而导致基因组不稳定,从而增加有丝分裂错误的频率。因此,通过添加去除中心粒的PLK4抑制,无论癌细胞是否具有中心体或PCM,都将无法组织有助于细胞分裂过程中DNA分裂的管道。
总之,这项研究表明,抑制PLK4或中心体复制及组装相关的其他调节因子,是选择性靶向由17q23扩增驱动的乳腺癌或其他肿瘤的一种前途治疗策略。目前,研究人员正在寻找与PLK4抑制剂相似的其他更稳定的药物,并尝试鉴定对这些抑制剂敏感的其他人类癌细胞系。
原始出处:
Zhong Y Yeow, Bramwell G Lambrus, Rebecca Marlow, et al.Targeting TRIM37-driven centrosome dysfunction in 17q23-amplified breast cancer.Nature. 2020 Sep 9. doi: 10.1038/s41586-020-2690-1.
作者:探索菌
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#Nat#
47
#癌细胞#
53
#细胞分裂#
51
学习
119