ACS Appl. Mater. Interfaces:苏州医工所治疗肝癌的多功能纳米载药系统研究获进展
2018-01-30 佚名 苏州生物医学工程技术研究所
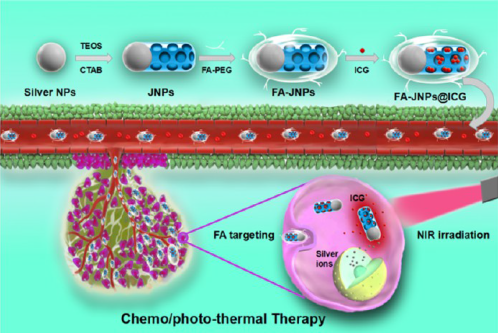
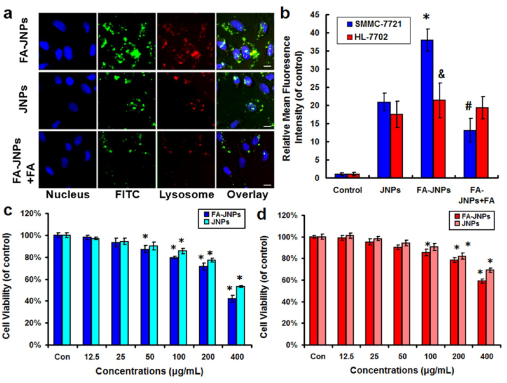
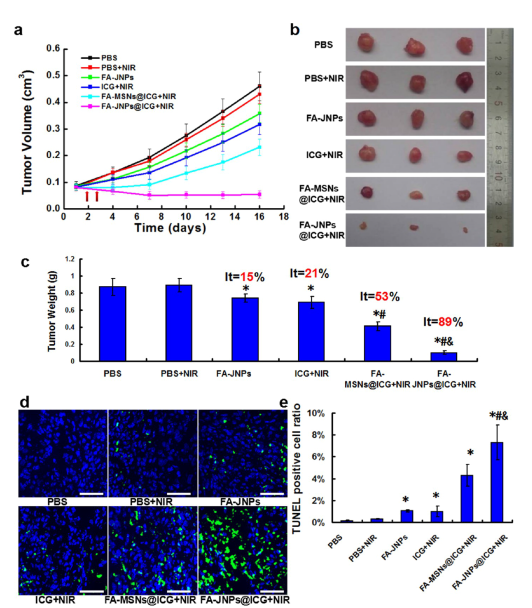
近些年来,科学家们发现了光热治疗的热效应可以促进银纳米材料释放银离子。而银离子在细胞内可以产生活性氧自由基,并通过线粒体凋亡途径诱导细胞凋亡。因此,银纳米材料协同光热治疗将是一种高效安全的肿瘤治疗策略。但相关研究面临难题和挑战,一是如何将光敏剂 ICG 和银纳米材料同时输送到肿瘤组织以增加癌症的治疗效果,二是如何开发一种开关去调控银离子的释放与 ICG 的剂量以增加治疗的安全性,三是如何提高其对肿
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





#纳米载药#
48
#研究获进展#
44
#FAC#
42
#ACE#
42
#ACS#
49