Thorac Cancer:真实世界中晚期NSCLC患者伴有KRAS、MET、FGFR、RET、BRAF和HER2改变时一线使用免疫检查点抑制剂(ICIs)的疗效
2022-05-27 yd2015 网络
除MET改变外,不管驱动基因改变如何,一线ICI对晚期NSCLC的疗效相似。
在驱动因子改变的非小细胞肺癌(NSCLC)患者中,免疫检查点抑制剂(ICIs)的有效性仍不确定。近期,有相关结果发表在Thoracic Cancer杂志上,研究旨在评估真实世界中晚期NSCLC患者伴有KRAS、MET、FGFR、RET、BRAF和HER2改变时一线使用ICI的疗效。

这项单中心、回顾性队列研究纳入KRAS、MET、FGFR、RET、BRAF、HER2改变或驱动基因阴性的晚期NSCLC患者,并接受一线ICI治疗。评估最佳总应答、无进展生存期(PFS)和总生存期(OS)。
78例NSCLC患者被纳入研究(中位年龄72岁):67%为男性,15%从不吸烟,83%为腺癌。驱动基因改变包括KRAS (n = 21)、MET (n = 6)、FGFR (n = 3)、RET (n = 2)、BRAF (n = 2)、HER2 (n = 1)和驱动基因阴性(n = 43)。所有患者均接受一线ICIs治疗:帕博利珠单抗单药治疗24例(31%),ICI联合化疗46例(59%),Nivolumab联合ipilimumab3例(3.8%),以及Nivolumab和ipilimumab联合化疗5例(6.4%)。68例患者可知PD-L1状态(87%)。50例(64%)患者PD-L1表达阳性,定义为肿瘤比例评分(TPS)≥1%,31例(40%)患者PD-L1高表达(TPS≥50% )。
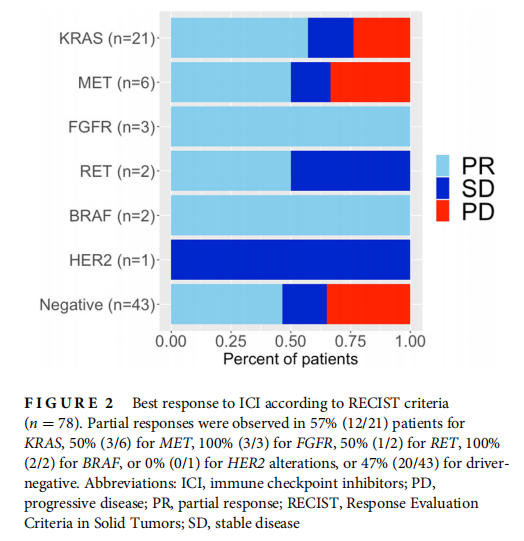
在78例可评估疾病的患者中,41例(53%)患者观察到客观缓解(ORR), 15例(19%)患者病情稳定(SD), 22例(28%)患者病情进展(PD)。KRAS、MET、FGFR、RET、BRAF、HER2和驱动基因阴性的部分应答分别为57%、50%、100%、50%、100%、0%和47%。对35例驱动基因改变患者(KRAS、MET、FGFR、RET、BRAF和HER2)的联合分析显示,21例患者出现ORR(60%), 7例患者出现SD(20%), 7例患者出现PD(20%)。驱动基因改变组与驱动基因阴性组的ORR差异无统计学意义(60% vs. 47%, p = 0.26)。
整体队列患者的中位PFS为10.1(95%可信区间[CI]: 5.5 - 15.7)个月,和12个月PFS率为42.1% (95% CI: 31.9% 55.5%)。KRAS、MET、其他基因改变(FGFR、RET、BRAF、HER2)和驱动基因阴性患者的中位PFS分别为16.2 (95% CI: 6.3–NR)个月,2.8 (95% CI: 2.7–NR)个月, 11.7 (95% CI: 5.9–NR) 个月, 和10.0 (95% CI: 3.7–14.3)个月。对35例驱动基因改变患者(KRAS、MET、FGFR、RET、BRAF和HER2)的联合分析显示,中位PFS为11.7个月(95%CI:5.5-NR)。驱动基因改变组与驱动基因阴性组的中位PFS差异同样无统计学意义(11.7 vs. 10.0 个月, p = 0.23)。
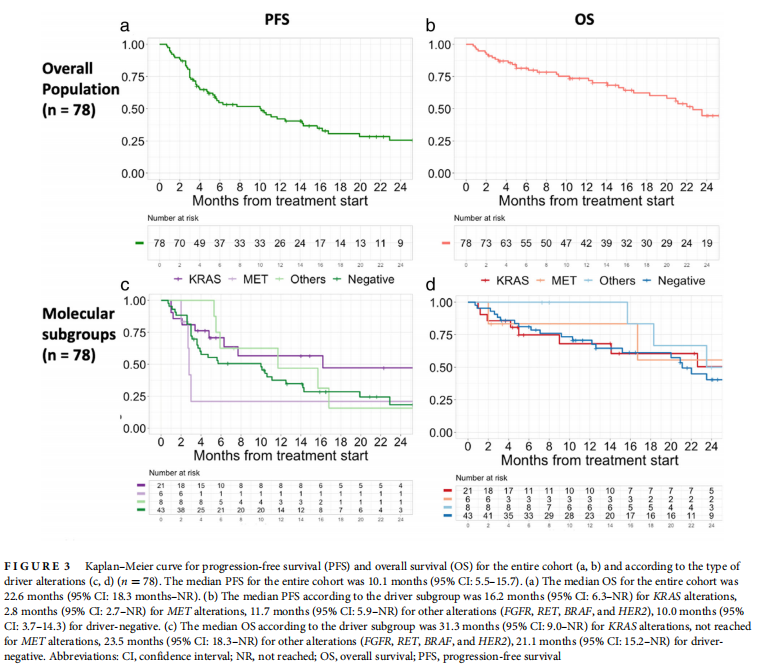
整个队列的中位OS为22.6个月(95% CI: 18.3 NR), 12个月的OS为73.6% (95% CI: 64.0% 84.7%)。KRAS、MET、其他基因改变(FGFR、RET、BRAF、HER2)和驱动基因阴性患者的中位PFS分别为31.3 (95% CI: 9.0–NR)个月, 未达到, 23.5 (95% CI:18.3–NR)个月,和21.1 (95% CI: 15.2–NR) 个月。对35例驱动基因改变患者(KRAS、MET、FGFR、RET、BRAF和HER2)的联合分析显示,中位OS为23.5 (95% CI: 16.7–NR)。驱动基因改变组与驱动基因阴性组的中位OS差异同样无统计学意义(23.5 vs. 23.1 个月, p = 0.35)。

KRAS G12C突变(n = 7)与KRAS非G12C突变(n = 14)的ORR差异无统计学意义(71% vs. 50%, p = 0.64)。KRAS突变状态(KRAS G12C vs.其他KRAS突变)与中位PFS(26.6个月vs. 16.2个月,p = 0.54)或中位OS (NR vs. 22.6个月,p = 0.33)无显著相关性。

综上,除MET改变外,不管驱动基因改变如何,一线ICI对晚期NSCLC的疗效相似。
原始出处:
Uehara Y, Watanabe K, Hakozaki T, Yomota M, Hosomi Y. Efficacy of first-line immune checkpoint inhibitors in patients with advanced NSCLC with KRAS, MET, FGFR, RET, BRAF, and HER2 alterations. Thorac Cancer. 2022 May 2. doi: 10.1111/1759-7714.14448. Epub ahead of print. PMID: 35491960.
作者:yd2015
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#RET#
50
#SCLC患者#
39
#CIS#
39
#MET#
36
#抑制剂#
40