【Leukemia】早期低危霍奇金淋巴瘤PET2驱动治疗:3期HD16研究5年随访结果
2023-11-08 聊聊血液 聊聊血液
近日《Leukemia》发表了该研究随访64个月长期随访的最终分析结果。
早期HL的PET驱动治疗
由于早期低危霍奇金淋巴瘤 (HL) 患者接受一线联合治疗 (combined modality therapy,CMT) 后的长期缓解率已经超过90%,因此当前的研究更强调改善长期副作用与肿瘤控制之间的平衡。早期低危HL广泛使用的的标准治疗是使用两个周期的多柔比星、博来霉素、长春碱和达卡巴嗪 (ABVD) 治疗,随后进行 20Gy 累及野放疗 (RT)。然而很多学者认为 CMT 概念内的 RT 巩固比化疗害处更大。
因此,多项研究评估了使用正电子发射断层扫描 (PET) 是否有助于从标准方案中省略RT,包括德国霍奇金研究组 (GHSG) HD16 研究。HD16研究旨在证明与 CMT 相比,在两个周期 ABVD后 PET (PET-2)阴性的患者中省略RT巩固,在无进展生存期 (PFS) 方面具有非劣效性。还分析了在接受 CMT 治疗的患者中,PET-2阳性是否是 PFS 的风险因素。近日《Leukemia》发表了该研究随访64个月长期随访的最终分析结果。

研究方法
随机 III 期HD16研究在德国、瑞士、奥地利和荷兰的250家研究中心开展,纳入18–75岁的新诊断、组织学证实的临床 I 或 II 期典型 HL 患者,或Ann Arbor IB、IIA或 IIB 期结节性淋巴细胞为主的 HL 患者,无任何 GHSG 风险因素大纵隔肿块(≥1/3最大胸径)、结外病变,红细胞沉降率升高(≥50 mm/h且无 B 症状,≥30 mm/h且有 B 症状)或累及淋巴结区域≥3个。
患者以1:1的比例集中随机分配至两个平行治疗组,患者接受2×ABVD的标准CMT和20Gy累及野放疗(IF-RT)或CMT后PET驱动治疗,即PET-2阴性(Deauville评分<3)患者省略累及野放疗。两组在第二个 ABVD 周期的第22天和第35天之间进行PET-2,多学科专家小组进行盲态中心审查,并使用纵隔血池作为阳性临界值 (DS≥3),根据 DS 进行评级。
主要终点为PFS,次要终点包括OS、至第二原发肿瘤(SPM)时间、至射野内和射野外复发时间、随访5年后平均左心室射血分数 (LVEF)、至首次分娩时间等。
研究结果
入组并随机分配1150例患者(图1)。
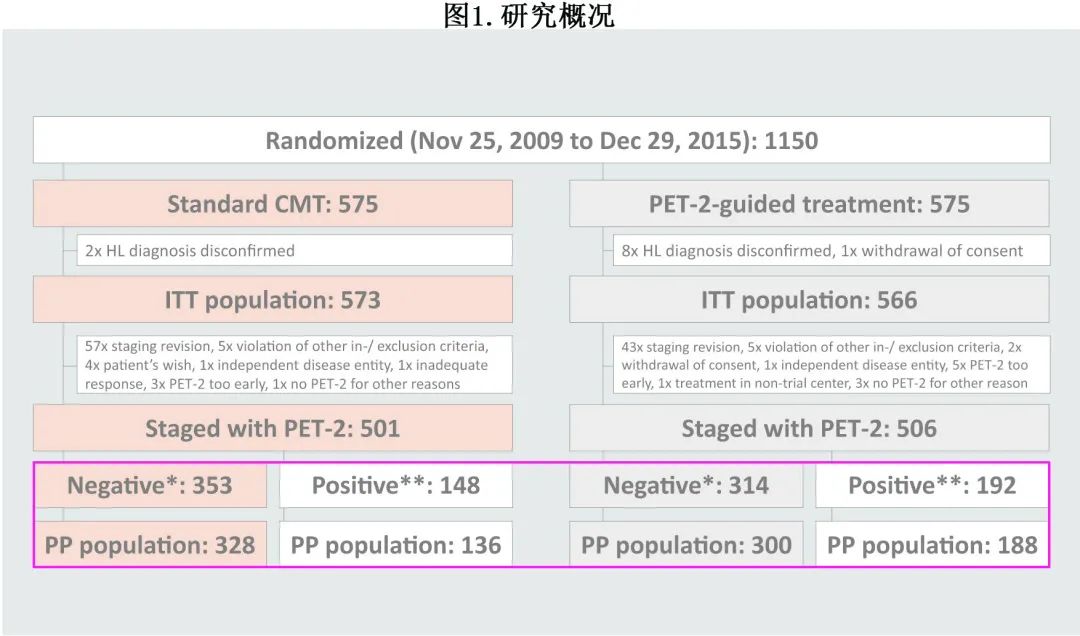
在接受中心审查 PET-2 的1007例患者中,340例为阳性(218例为DS 3,122例为DS 4,0例病例为DS 5);在 PET-2 阴性的667例患者中,符合方案集(PPS)包括628例患者,其中328例接受标准 CMT 治疗,300例仅接受 ABVD 治疗。患者特征如下,此外在 ITTPET (PET-2中心审查前脱落的所有患者,均从试验主要目的分析中排除)及 PET-2 阴性符合方案人群中,两随机治疗组之间相似。

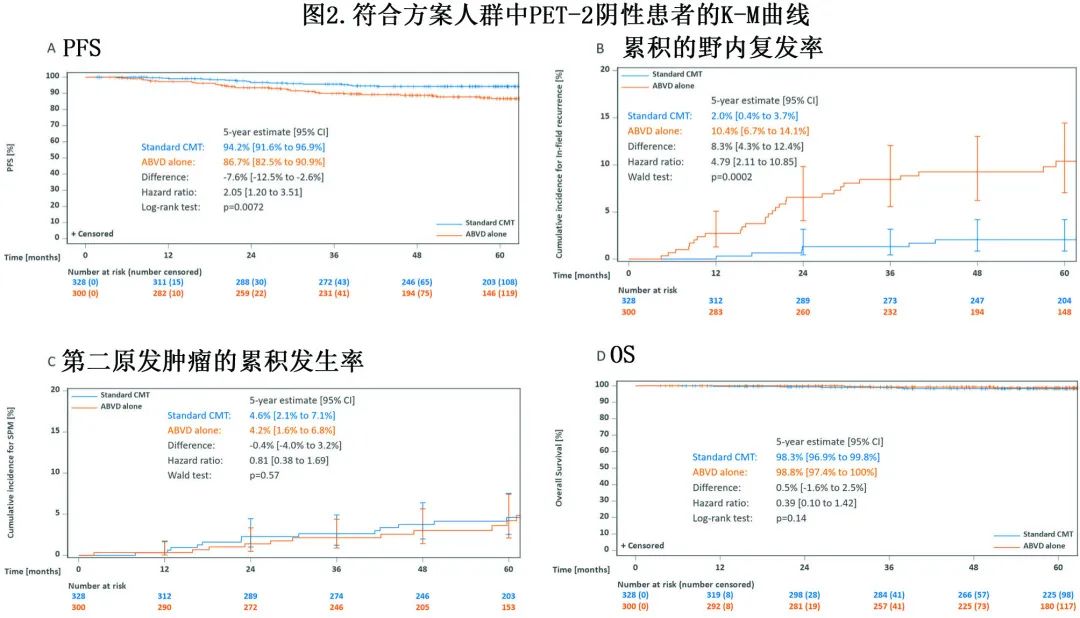
中位随访64个月,PET-2阴性符合方案人群5年 PFS 估计值,CMT患者为94.2%,单纯 ABVD 患者为86.7%(图2A)。HR 为2.05时,相应的 95%CI 范围为1.20-3.51,包括预先定义的非劣效性界值3.01。ITT 分析也得到了相似的结果(CMT的5年 PFS 为94.0%,单纯 ABVD为86.6%,HR为1.99[1.19-3.34])。PFS 差异主要是由于单纯 ABVD 组野内复发的发生率,CMT后5年累积发生率为2.0%,单纯 ABVD 后5年累积发生率为10.4%(p=0.0002,图2B),而两组间野外复发较平衡(5年累积发生率3.7% vs 6.4%,p=0.37)。
大多数患者在疾病进展或复发时接受大剂量化疗 (HDCT) 和自体干细胞移植 (ASCT)(表1)。

CMT 和单独 ABVD 治疗的患者分别有17例和12例发生SPM(表1),相应的5年累积发生率分别为4.6%和4.2%(p=0.57,图2C)。
OS 的中位随访时间为66个月,分别有9例和3例患者死亡,包括4例 SPM 死亡和1例 HL 死亡(表1)。在符合方案分析中,CMT的5年 OS 为98.3%,单纯 ABVD 为98.8%(p=0.14,图2D)。
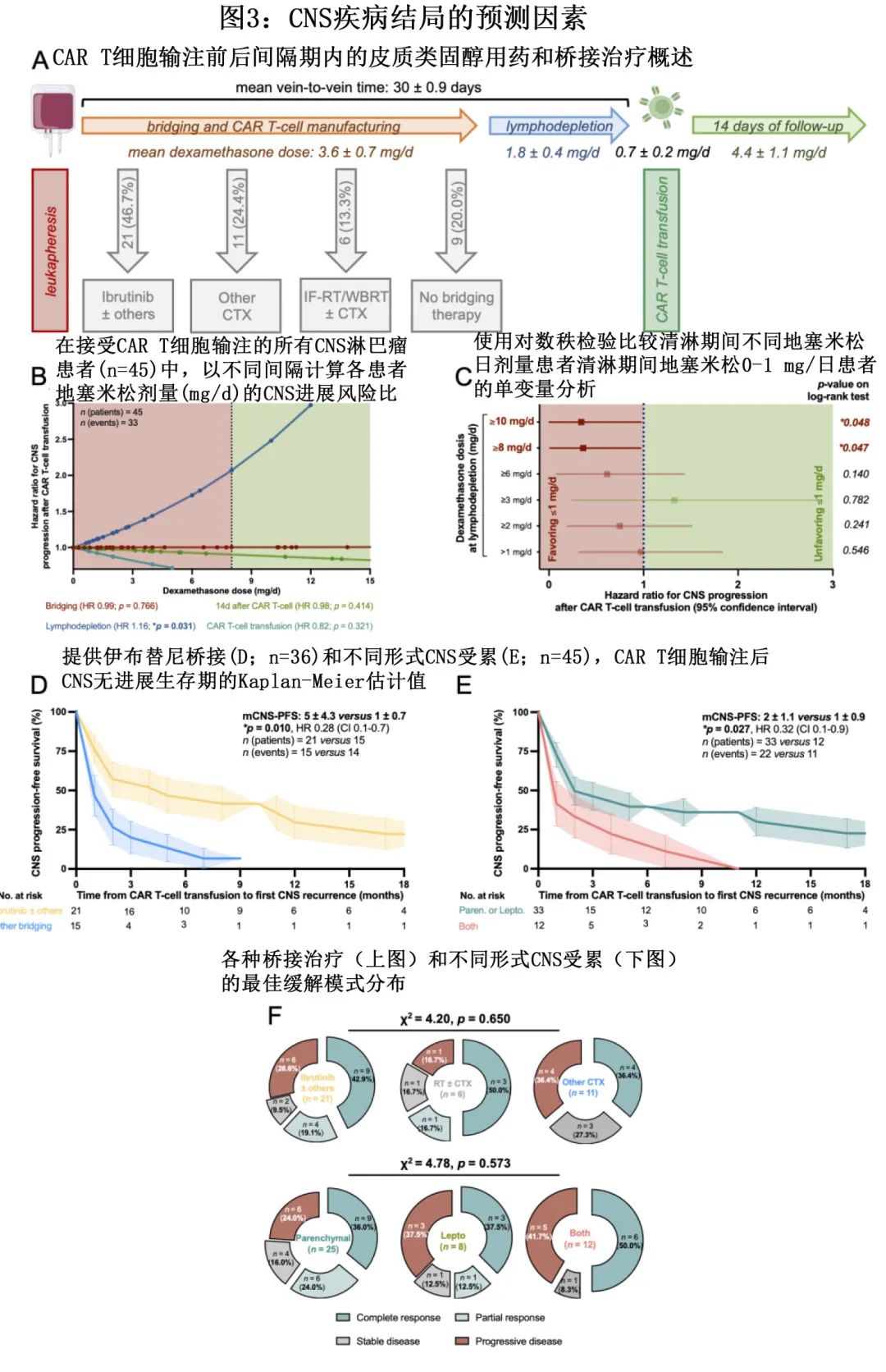
除340例 PET-2 阳性患者(即DS≥3)外,还有353例 PET-2 阴性患者(即DS 1-2)分配接受CMT。中位随访64个月,PET-2阴性后估计5年 PFS 为94.0%,PET-2阳性后估计5年 PFS 为90.3%(p=0.012,图3A)。
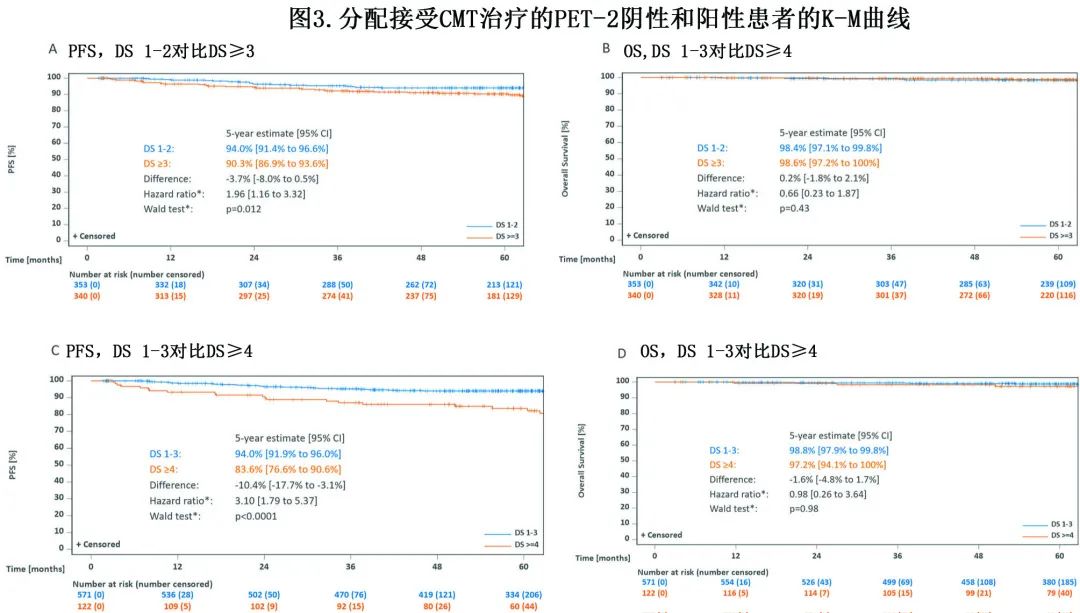
分别有9例和8例死亡,PET-2阴性和阳性亚组的 OS 相似(98.4% vs 98.6%;p=0.43,表2,图3B)。
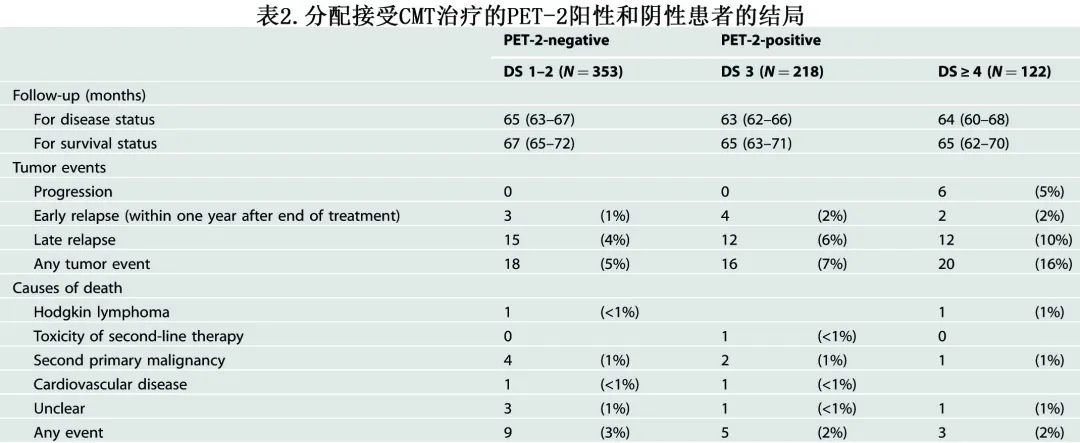
使用不太保守和更常用的 PET-2 阳性DS 4作为临界值,PET-2的预后价值变得更加明显,DS 1-3后估计的5年 PFS 率为94.0%,DS≥4后为83.6%(p<0.0001,图3C);但此时OS仍无差异(图3D)。此外PET-2 阳性患者野内和野外复发均较多。
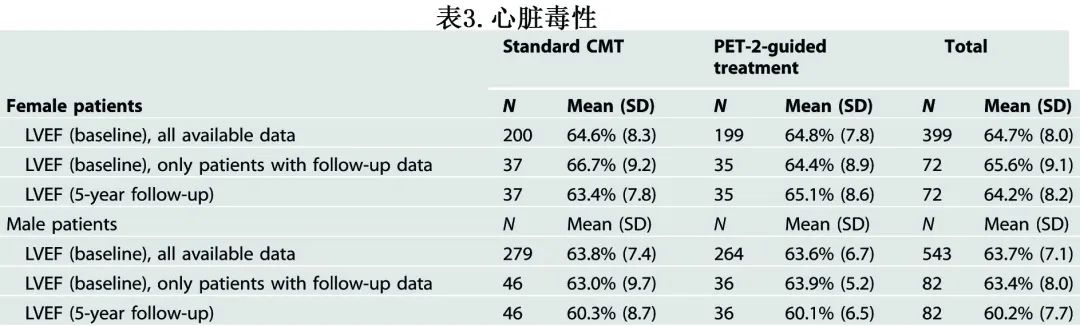
治疗组之间以及男性和女性患者之间5年后心脏毒性的 LVEF 均无显著差异(表3)。
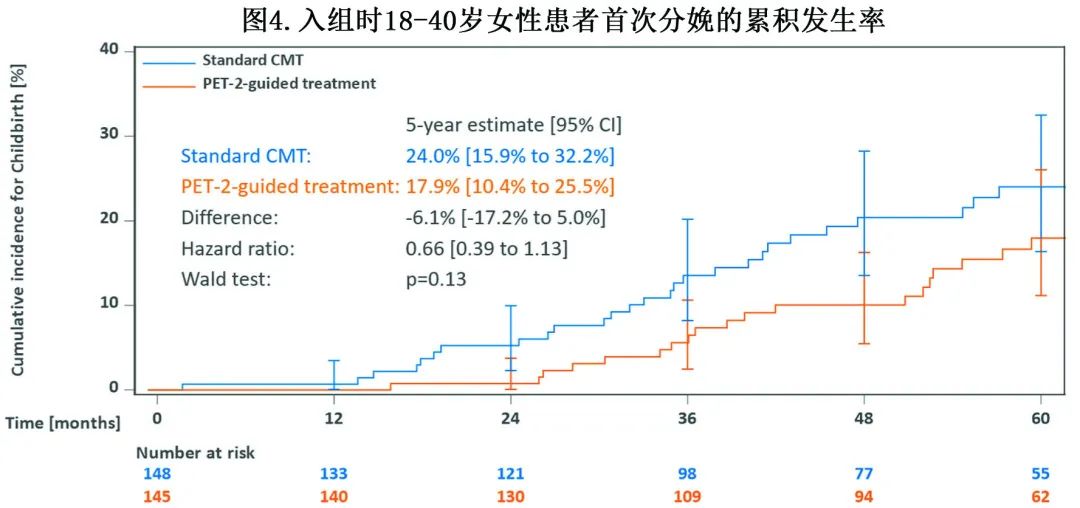
在研究治疗结束后63个月的中位随访期内,入组时293例18-40岁的女性中有54例报告分娩。分配到标准 CMT 组的患者5年后分娩的累积发生率为24.0%,PET驱动治疗组为17.9% (图4)。在54例后来有孩子的女性中,有10例 (19%) 在治疗开始前冷冻卵子,1例报告使用了低温材料(受精的卵母细胞,接受CMT以及乳腺癌治疗后)。
在治疗后62个月的中位随访期内,入组时年龄为18-60岁的590例男性患者中有37例报告有孩子,其中28例 (76%) 患者在治疗前进行了精子冷冻保存,但关于是否使用过低温材料的信息不可用。
总结
该分析报告了3期GHSG HD16的长期结局。总体而言,1150例18-75岁新诊断的早期低危 HL 患者随机分配接受标准联合治疗 (CMT)(2xABVD,随后进行PET/CT[PET-2] 和20Gy 累及野RT)和PET-2驱动治疗,后者在PET-2阴性(DS<3)的情况下省略RT。该研究旨在排除 PET-2 驱动治疗的劣效性,并评估 PET-2 在接受 CMT 的患者中的预后影响。
中位随访64个月,PET-2阴性患者 CMT 后5年PFS率为94.2%(n=328),单纯 ABVD 后为86.7%(n=300;HR=2.05;p=0.0072),5年 OS 分别为98.3%和98.8%(p=0.14);4/12例记录的死亡由第二原发恶性肿瘤引起,仅1例由 HL 引起。在分配至 CMT 的患者中,PET-2阴性患者 (n=353;94.0%) 的5年 PFS 优于 PET-2 阳性患者 (n=340;90.3%;p=0.012),且当使用 DS4 作为临界值时差异更明显 (DS 1-3:n=571;94.0% vs. DS≥4:n=122;83.6%;p<0.0001)。
综上所述,无论 PET-2 结果如何,CMT均应被视为早期低危HL的标准治疗。由于 PET-2 阳性 (DS≥4) 对 PFS 有相关负面影响,因此需要创新的治疗策略来改善这些患者一线治疗后的结局。
参考文献
Fuchs M, et al. Follow-up of the GHSG HD16 trial of PET-guided treatment in early-stage favorable Hodgkin lymphoma.Leukemia . 2023 Oct 16. doi: 10.1038/s41375-023-02064-y.
作者:聊聊血液
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言