专家论坛|王伽伯/肖小河:中草药相关肝损伤的表型特征及毒理机制
2024-09-04 临床肝胆病杂志 临床肝胆病杂志
本文就近年来HILI相关的研究进展进行综述,以期为临床安全合理用药和研究提供参考。
《淮南子·修务训》中记载:“神农……尝百草之滋味……一日而遇七十毒”,早在古代,人们对中草药毒性就有了一定的认知,并在长期的医疗实践中逐渐发展,形成了中草药毒理认知体系。随着人类疾病谱与人们使用中药的目的、行为和方式等发生变化,以及中医药在全球广泛使用,中草药相关肝损伤(HILI)等中药安全性问题频频发生,有的与传统“有毒”中药有关,有的与传统“无毒”中药有关,为进一步厘清HILI表型特征及毒理机制,本文就近年来HILI相关的研究进展进行综述,以期为临床安全合理用药和研究提供参考。
1HILI的表型特征
HILI临床表型分布十分广泛,且有多种分类方式(表1)。

1.1 依据受损靶细胞分型
目前HILI基于受损靶细胞临床表型可分为肝细胞损伤型、胆汁淤积型、混合型和肝血管损伤型。各型诊断依据分别为:(1)肝细胞损伤型:ALT≥3倍正常值上限(ULN),且R≥5[R=(ALT实测值/ALT ULN)/(ALP实测值/ALP ULN)];(2)胆汁淤积型:ALT≥2×ULN,且R≤2;(3)混合型:ALT≥3×ULN,ALP≥2×ULN,且2<R<5;(4)肝血管损伤型:受损靶细胞可为肝窦、肝小静脉、肝静脉主干及门静脉等的内皮细胞。
肝细胞损伤型最为常见,临床表现包括肝区不适、乏力、恶心、食欲下降等,潜伏期通常较短。黄药子、雷公藤等均可直接破坏肝细胞而引起肝损伤。胆汁淤积型常伴有尿黄、目黄、皮肤瘙痒等临床症状,潜伏期较肝细胞损伤型稍长,涉及的中草药包括苍耳子、白鲜皮、番泻叶等。混合型肝损伤临床无特异性表现,发生率与胆汁淤积型相似,潜伏期长短不一,涉及的中草药有决明子、细辛等。此外,含有吡咯环结构的中药土三七、千里光可引起肝窦阻塞综合征,属于肝血管损伤型的代表。
1.2 依据病程分型
大部分HILI在停用中草药后肝功能可恢复正常,但少部分患者肝功能迁延不愈,发展为慢性HILI。依据病程,HILI可分为急性HILI和慢性HILI。急性HILI需同时具备以下3个条件:(1)HILI发生6个月内;(2)肝功能恢复正常;(3)无明显影像学和组织学肝功能损伤证据。慢性HILI需同时具备以下3个条件:(1)HILI发生6个月以后;(2)肝功能持续异常;(3)或存在门静脉高压或慢性肝损伤的影像学和组织学证据。
慢性HILI主要与高龄、血脂异常、发病时严重程度相关,研究显示,胆汁淤积型更容易发生慢性HILI。纪冬团队构建了新型无创列线图模型用于预测慢性药物性肝损伤的预后。邹正升团队新近研究发现36周短疗程激素治疗方案可成功用于慢性药物性肝损伤的治疗。文献报道,何首乌、雷公藤、黄药子等可导致慢性HILI。
1.3 依据严重程度分型
《中草药相关肝损伤临床诊疗指南》推荐HILI严重程度分为0~5级。0级:无肝损伤,患者对暴露中草药及其制剂可耐受,无肝毒性反应。1级:轻度肝损伤,血清ALT和/或ALP呈可恢复性升高,TBil<2.5 mg/dL且INR<1.5。2级:中度肝损伤,血清ALT和/或ALP升高,且TBil≥2.5 mg/dL或虽无TBil升高但INR≥1.5。3级:重度肝损伤,血清ALT和/或ALP升高,TBil≥5 mg/dL,伴或不伴INR≥1.5。4级:肝衰竭,血清ALT和/或ALP升高,且TBil≥10 mg/dL或每日上升1 mg/dL,INR≥1.5,或PTA<40%,可同时出现:(1)腹水或肝性脑病;或(2)与HILI相关的其他器官功能衰竭。5级:致死性肝损伤,因HILI死亡或需要接受肝移植才能存活。中草药导致肝损伤的严重程度与药物的剂量大小、服用时间的长短、机体差异、联合用药间相互作用等多种因素有关,多数情况下及时停药后肝功能恢复良好,偶有发生急性肝衰竭甚至死亡。
1.4 依据组织病理学分型
肝组织病理对于HILI确立诊断、病情评估、预后判断均起到重要作用。HILI组织病理学表现多种多样,按照组织病理学改变可分为炎症坏死型、胆汁淤积型、脂肪肝和脂肪肝炎型、血管损伤型、轻微病变型。炎症坏死型是最常见的HILI病理模式,表现为炎症和/或肝细胞坏死。多种中草药可引起炎症坏死型HILI,包括闹羊花、附子等。肝组织胆汁淤积机制有胆汁积聚和胆汁酸积聚2种形式。HILI胆汁淤积包括3种基本组织病理学模式,即混合性淤胆型肝炎、胆管损伤和单纯性淤胆,苍耳子、雷公藤、白鲜、黄药子、番泻叶等常导致这一类型病理模式。部分中草药可导致肝脏大泡脂肪变性病理改变,临床应首先排除非酒精性脂肪性肝病、酒精性肝病等基础疾病。中草药可引起从门静脉小分支到肝静脉大分支的任何水平肝血管损伤,代表药物有土三七、千里光等。
1.5 中医辨证分型
HILI中医辨证分型目前尚无统一标准,我国《中草药相关肝损伤临床诊疗指南》将HILI中医证型归纳为湿热黄疸、肝郁脾虚、寒湿瘀阻、气滞血瘀、肝肾阴虚等。笔者团队对187例HILI病例进行中医辨证分型,发现湿热黄疸为最常见证型,其次为肝郁脾虚和肝肾阴虚证型,不同中医证型的HILI在肝损伤生化特点及预后方面并不一致。
然而,真实世界中,中草药导致肝损伤的临床表型并非一一对应关系,而是多种临床表型的综合呈现,可以是以某个表型为主,也可以不同病程阶段呈现不同的表型。总之,从不同角度识别HILI的临床表型有助于更好地认识疾病、精准治疗、判断预后以及了解其毒理机制。
2中草药肝毒性的分类及其毒理机制
中草药种类繁多、成分多样、临床用药复杂、存在混伪劣品外来污染物等多种因素,依据传统“有毒”和“无毒”中药分类及现代临床药理研究结果,中草药肝毒性主要可分为直接(固有)肝毒性和特异质肝毒性两类。近年来,随着对中药肝毒性的深入认识,有研究提出与药物药理作用相关的间接毒性概念,但传统概念中将间接毒性归属于特异质毒性范畴。此外,肖小河教授团队首次提出中草药毒性认知的4种模式:固有型毒性、特异质毒性、间接型毒性和混合型毒性(图1)。不同类型的毒性模式重在区分影响因素和主次关系差异,图1中橙色、绿色、蓝色分别代表药物因素、机体因素和用药因素,而固有型毒性是以药物因素为主导,机体因素和用药因素的贡献度依次减弱;特异质毒性是以机体因素(遗传、体质、病证)为主导,药物本身和用药因素均为次要因素;间接型毒性则是以用药因素(药理作用、药物互作)为决定性因素,药物因素和机体因素贡献作用较弱;混合型毒性的特点为药物、机体、用药多种因素协同作用,且三种因素都很重要,常见于中药复方情况。新的毒性认知体系既符合传统的“有故无殒、以毒攻毒”中药理论,又符合“易感成分、靶点互作”的现代科学语言,科学厘清药物、遗传、体质、病证、用药等因素对中药安全性的影响因素及主次规律,为中药毒理学研究和安全精准用药提供了奠基性的理论支撑。
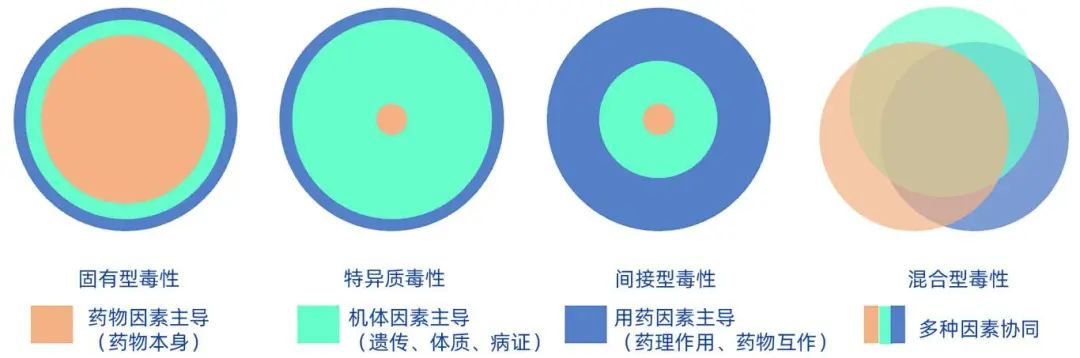
图1 中草药肝毒性分类、影响因素及主次关系
中药的疗效和毒性取决于其物质基础,既往的HILI毒理机制研究多从中药固有肝毒性的物质基础和作用机制角度开展,随着对中草药特异质肝毒性、间接肝毒性和混合型毒性认识的深入,传统从中药物质基础单维度对其毒理机制开展研究已无法满足中药肝毒性研究现状,因此,本文将从中草药毒性认知新模式,即固有型毒性、特异质毒性、间接型毒性和混合型毒性四个维度对HILI可能的毒理机制开展探讨和综述(表2)。
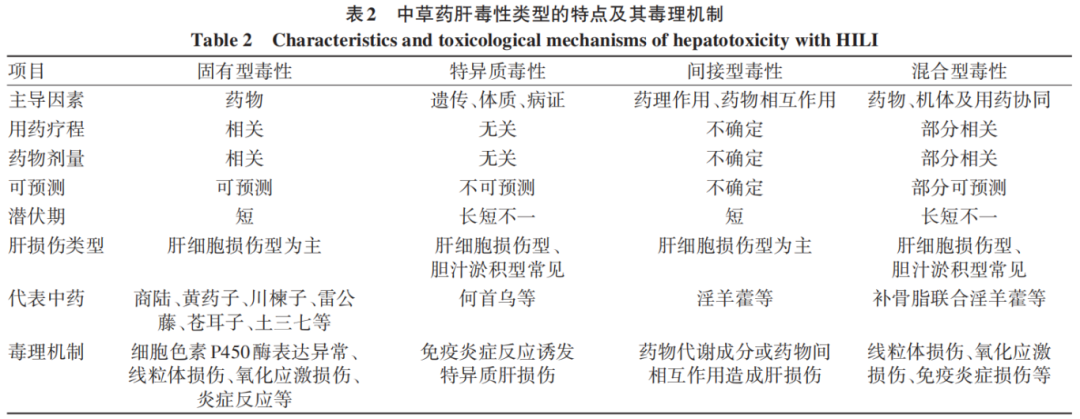
2.1 中草药固有型肝毒性及其毒理机制
固有型肝毒性是指“有毒”中药本身对肝脏造成的直接损伤,药物因素是肝损伤的主导因素,遗传、体质、病证等机体因素贡献的作用较小。固有型毒性肝损伤与用药疗程、剂量关系明确,这种损伤在动物模型中是常见的、可预测的、剂量依赖和可再现的,潜伏期通常较短。我国历代本草专著都对有毒中药进行“大毒”“有毒”“小毒”“无毒”等类似的毒性分级。固有型肝毒性主要指“大毒”和“有毒”中草药的肝毒性,中药固有型肝毒性的代表药物有:含皂苷类毒性成分的商陆、黄药子等;含生物碱类如吡咯里西啶生物碱的千里光、菊三七等;含萜类化合物的雷公藤、川楝子等;含有糖苷类的牛蒡子、苦参;苍耳子中的植物毒性蛋白、蓖麻精中的蓖麻毒素和相思子中的相思豆毒蛋白等均可导致肝损伤发生。
中草药固有型毒性的发生机制主要与其含有的毒性物质有关。既往研究报道发现这一类型肝损伤可能的潜在毒理机制主要有细胞色素P450酶表达异常、线粒体损伤、氧化应激损伤、炎症反应等。郑江课题组研究发现中药黄药子肝脏毒性的物质基础是呋喃萜类成分,进入体内被CYP3A代谢后的产物进一步与蛋白质和核酸形成共价结合产生毒性。中草药诱导线粒体损伤的机制主要表现在结构损伤和功能紊乱两个方面。如大黄中的蒽醌能引起细胞周期阻滞、线粒体膜电位去极化和线粒体呼吸链复合体抑制功能,进而损害线粒体功能,最终导致肝毒性。雷公藤甲素通过抑制线粒体呼吸链来诱导肝损伤,也可能涉及Drp1相关的线粒体功能障碍和线粒体自噬。李峰杰等发现,给予大鼠大剂量山豆根7 d后,动物肝组织中超氧化物歧化酶/丙二醛比值及谷胱甘肽含量显著下降,γ-谷氨酰转肽酶水平显著上升,提示山豆根肝毒性的机制可能与自由基产生的氧化应激有关。大剂量川楝子可导致肝细胞损伤,肝细胞急性坏死是川楝子肝损伤的主要形式。川楝子导致细胞坏死通路中,抗氧化活性物质(超氧化物歧化酶、谷胱甘肽过氧化物酶)含量的降低、过氧化产物(MDA)及炎症因子(NF-κB、ICAM-1、TNF-α)含量的增多起到了重要作用,提示炎症反应可能为川楝子致肝细胞损伤的作用机制之一。
中草药固有型毒性发病机制的特点决定了其肝损伤表型多以肝细胞损伤型为主,也有肝血管损伤型等,通常潜伏期较短,且急性发病,大部分预后良好,少数进展为慢性肝损伤。损伤的病理类型可包括肝细胞损伤、肝血管损伤、炎症坏死型、脂肪肝和脂肪肝炎型等。
2.2 中草药特异质肝毒性及其毒理机制
中草药特异质毒性是由传统“无毒”或“小毒”中草药引起的肝损伤,机体因素(包括遗传、体质、免疫代谢、病证等)是此类型肝损伤的主导因素,与药物因素相关性较小。特异质肝毒性仅在极少数情况下发生,通常发生率较低。特异质肝毒性在中药传统毒性理论认知中几乎空白,这种损伤不可预测,不依赖剂量,也无法在动物模型中重现。肖小河团队研究发现何首乌致肝损伤的免疫特异质属性,并发现何首乌致特异质肝损伤易感基因HLA-B*35:01,携带该基因的人群服用何首乌发生肝损伤的概率明显高于不携带该基因的人群。涂灿研究发现血管内皮生长因子、P-10、MCP-1、TNF-α等细胞因子与何首乌肝损伤易感性高度相关,筛选并证实细胞因子类TNF-α和MCP-1或血管内皮生长因子可作为预测何首乌特异质肝损伤易感人群的生物标志物。Zhang等利用代谢组学技术对何首乌的肝损伤易感个体进行血清分析发现,耐受个体与易感个体在血清代谢上存在显著差异,其中主要差异代谢物25个,涉及甘油磷脂代谢和鞘脂代谢等多个代谢途径,可通过这些差异代谢物进行识别和预测何首乌特异质肝损伤易感个体。
中草药特异质肝毒性由于受机体特异性体质、遗传背景、基础疾病、病证状态等因素的影响较大,常规毒理学试验难以客观真实地反映药物临床安全性,王伽伯团队运用病证毒理学相关模型和目标成分“敲出/敲入”毒效物质辨识方法等技术手段发现,何首乌特异质肝损伤与其含有的二苯乙烯类和蒽醌类成分的结构及含量有关。在免疫过度活化状态下,何首乌中顺式二苯乙烯苷(cis-SG)和大黄素-8-O-β-葡萄糖苷均可诱导肝损伤。而药材中等比剂量的反式二苯乙烯苷(trans-SG)可通过增强免疫活性加重cis-SG诱发的肝损伤,从而证实了何首乌肝损伤是机体免疫炎症、何首乌中免疫促进物质和肝损伤易感成分三者协同所导致的,进一步提出了中药(何首乌)免疫特异质肝损伤“三因致毒”机制假说,即当机体处于免疫炎症异常活化状态时,何首乌中的免疫促进物质(如trans-SG)进一步增强机体免疫炎症反应,使肝脏对何首乌中肝损伤易感成分(如cis-SG)的敏感性增强,从而诱发特异质肝损伤。
中草药特异质毒性导致的肝损伤临床表型包括肝细胞损伤型和胆汁淤积型常见,潜伏期长短不一,病程长短及预后与年龄、性别和机体因素相关,部分可进展为慢性化肝损伤病程。特异质肝毒性可伴有自身抗体异常、免疫指标异常,部分病例进展为自身免疫性肝炎。个别病例由于过度免疫活化,机体出现严重炎症反应而诱发急性肝衰竭。肝组织病理表型为肝细胞坏死、胆管损伤,严重时可致胆管消失综合征。
2.3 中草药间接型/混合型肝毒性及其毒理机制
中草药间接型毒性是以用药因素(包括药理作用、药物相互作用)为主导因素,机体因素和药物因素为辅助因素的一种肝毒性类型。是由中药活性物质通过药理活性作用引起的,并与基础疾病、病证状态、环境因素等密切相关,而不是由中药固有毒性或特异性毒性引起的。中药间接肝毒性部分有剂量依赖关系,在正常动物模型中通常不可复制。中药淫羊藿以间接毒性为主,所含淫羊藿次苷Ⅰ、淫羊藿次苷Ⅱ等成分可促进机体免疫反应,加剧肝脏免疫炎症损伤。《素问•五常政大论篇》曰:“人有能耐毒者,有不胜毒者,能毒者以厚药,不胜毒者以薄药”,可见药物毒性发挥受机体因素影响,甚至无毒中药在特定病证状态下可表现出毒性,比如“人参杀人无过”之说,提示人参可能会产生间接型毒性。目前,针对中药间接毒性的研究较少,随着中药毒性认识和研究的不断深化,未来对中药间接毒性认知也将会不断取得突破。
中草药混合型毒性是由中草药、机体、用药因素等多种因素协同导致的肝毒性,通常会同时含有2种或2种以上不同类型的毒性,且多见于中药复方。补骨脂因含有异补骨脂素、补骨脂酚等成分具有直接肝毒性;淫羊藿以间接毒性为主。补骨脂与淫羊藿同时应用后,可发生混合型毒性肝损伤,因此,临床报道的壮骨关节丸、仙灵骨葆胶囊等肝损伤风险属于混合型毒性。
柏兆方团队利用脂多糖易感性评价模型揭示了壮骨关节丸和仙灵骨葆胶囊等中药致免疫特异质肝损伤的客观性,结合拆方研究表明2种复方制剂中补骨脂和淫羊藿均可诱导免疫特异质肝损伤发生,且两者配伍时肝损伤最为严重,进一步对补骨脂和淫羊藿致肝损伤机制进行了深入研究,发现补骨脂不仅多个成分具有一定直接细胞毒性作用,同时还可以通过活化炎症小体诱发肝损伤,其中补骨脂二氢黄酮单独不激活炎症小体,但可特异性增强特定因素介导的NLRP3炎症小体活性,诱发肝损伤,而补骨脂定则可以通过直接活化NLRP3炎症小体活性介导免疫特异质肝损伤发生;此外补骨脂酚可通过直接活化AIM2炎症小体诱发免疫特异质肝损伤发生,可见补骨脂可通过不同机制活化炎症小体诱发免疫特异质肝损伤发生,同时其直接毒性物质亦可通过诱导细胞释放的ATP、DNA等损伤相关物质进一步加剧炎症小体活化,从而导致免疫特异质肝损伤发生,由此验证了中药免疫特异质肝损伤“三因致毒”机制假说。
肖小河团队进一步利用病证毒理学模型对淫羊藿致肝损伤机制进行研究,发现除淫羊藿次苷Ⅱ外,淫羊藿及其成分直接毒性较小,但淫羊藿中淫羊藿次苷Ⅰ、淫羊藿次苷Ⅱ、朝藿定B等多个成分可通过特异性增强ATP和nigericin介导的NLRP3炎症小体活性诱发肝损伤,可见淫羊藿免疫特异质肝损伤发生也是免疫活性成分与肝损伤易感成分协同所导致的。
目前,针对中草药间接毒性和混合型毒性研究较少,随着中草药毒性认识和研究的不断深化,未来对这两种模式的认知也将不断取得突破。
3总结
当今,不能再唯药物论毒性。从中草药毒性认知模式来看,不能局限于过去传统中草药的固有毒性,还应认识到特异质毒性、间接型毒性和混合型毒性等新的类型,这些类型为认识HILI毒理机制提供了全新视角。特别是对特异质毒性和间接型毒性来说,从机制上讲,药物因素不再是主导因素,还应从机体因素、用药因素等方面进行考虑,这些因素有时会成为决定性因素,对于了解HILI表型和毒理机制尤为重要。
为解决中草药非固有毒性肝损伤评价难题,肖小河团队传承创新中医“有故无殒”毒效思想,提出并构建了病证毒理学理论和方法,充分体现中医药的整体观和系统论,通过比较药物在正常和不同病证状态下的毒效应答差异,明确药物“病(证)-量-时-毒-效”关系,从而构建“安全治疗窗”,为中药安全性评价与风险防控提供了新路径。
现阶段,HILI表型特征及部分类型毒理机制资料仍然有限,本文内容或未能展示其全貌,期待未来随着对新毒性认知模式的深入研究,进一步积累并丰富相关内容。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH240804

作者:临床肝胆病杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#中草药# #中药毒理学# #化学性与药物性肝损伤#
71