MC-1(T)趋磁球菌“生物导弹”,可精准锁定攻击癌细胞
2016-08-25 周梦亚 动脉网
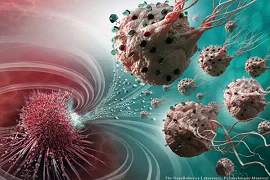
近日,自然杂志报道,蒙特利尔理工学院和麦克吉尔大学的研究人员在癌症治疗领域取得了新突破。利用一种特殊的生物细菌作为载药体,可精确的锁定癌细胞并投递药物,大大减少了用药量和副作用。 载药的“生物导弹”正在进攻癌细胞 传统化疗有很大的局限性。化疗药物具有高毒性,可以杀死快速增长的癌细胞。但不幸的是,药物没有针对性,往往在杀死癌细胞的同时也会杀死一部分正常的人体细胞,对人体造成伤害,有很强的副作用。
近日,自然杂志报道,蒙特利尔理工学院和麦克吉尔大学的研究人员在癌症治疗领域取得了新突破。利用一种特殊的生物细菌作为载药体,可精确的锁定癌细胞并投递药物,大大减少了用药量和副作用。
 载药的“生物导弹”正在进攻癌细胞
载药的“生物导弹”正在进攻癌细胞
传统化疗有很大的局限性。化疗药物具有高毒性,可以杀死快速增长的癌细胞。但不幸的是,药物没有针对性,往往在杀死癌细胞的同时也会杀死一部分正常的人体细胞,对人体造成伤害,有很强的副作用。
能不能有一种方法,只杀死癌细胞而保留人体正常的细胞呢?人们把目光投向了靶向治疗。靶向治疗是在细胞分子水平上,针对已经明确的致癌位点来设计相应的治疗药物,药物进入体内会特意地选择致癌位点来相结合发生作用,使肿瘤细胞特异性死亡,而且不会波及肿瘤周围的正常组织细胞。
发现:MC-1(T)趋磁球菌
Martel是加拿大纳米机器人研究中心主任,从事肿瘤靶向治疗研究15年。最初,他设想用微型机器人,也就是通常所说的纳米机器人,在磁场的作用下,通过血液将药物送达到指定的位置。但很遗憾,他说,“这已经超越了现在的技术,我们没有办法制造这样的纳米机器人。”
于是,Martel把目光投向了自然界:是否存在一种具有这种特性的细菌呢?事实证明他的假设是正确的。有一种细菌叫做趋磁球菌,利用鞭毛提供动力,可以在水中游动,他们天生配置含铁元素的指南针,具有导航能力。这就意味着他们可以利用磁场定向。
MC-1细菌属于趋磁球菌的一种。其中,在罗德岛Pettaquamscutt Estuary 低氧水域发现了一种叫做MC-1(T)的趋磁球菌,同时具有趋磁性和趋低氧性两种特征。众所周知,癌细胞具有繁殖迅速的特点,而细胞的大量繁殖需要消耗大量的氧气。也就是说,癌细胞大量繁殖的区域势必会形成一个低氧区,找到这个低氧区,就等于找到了大量的癌细胞。
如果将MC-1(T)球菌注射到人体内部,通过对磁场的控制将它们诱导至肿瘤附近,它们就可以自动找到肿瘤中癌细胞大量繁殖的区域,解决了靶向治疗中癌细胞如何锁定的难题。
试验:55%细菌进入了小鼠肿瘤的低氧区
那么如何实现载药呢?将药物封存到一个脂质囊泡中,作为一个微型的载药的袋子。Martel与蒙特利尔理工学院和麦克吉尔大学联合研究人员设计了一个化学“尼龙搭扣带”,可以将携带药物的袋子牢牢固定在趋磁菌表面。再将生物细菌与载物脂质离心混合,就可以得到载药的生物细菌,每个细菌大约能固定70个脂质体。
至于具体效果,研究人员在一只患有直肠癌的小鼠身上进行了多项实验。在老鼠体内注入几毫升的载药细菌。研究人员通过微弱的磁场来引导细菌到肿瘤区域,然后依靠细菌的趋低氧性,自动导航到肿瘤最活跃的部分。试验结果是,细菌在小鼠体内只能存活大约30分钟。可见,老鼠的体温对于细菌来说过高。
幸运的是,这些细菌游的非常快,大约每秒200个体长。相当于其他细胞的十倍,这可以使得它们很快的到达肿瘤位置。利用特殊的染料,可以区分出细菌,药物和不同区域的肿瘤。实验结束后,研究人员用显微镜对肿瘤和细菌进行观察。他们发现,1亿的细菌中,有大约55%进入了小鼠肿瘤的低氧区。
未来:临床应用之前还需大量的测试
化疗的副作用很大,而利用这些天然的生物导弹可将药物直接递向靶区,精准消灭杀死癌细胞,不仅减轻甚至是可能消除传统化疗的副作用,同时也提升了药物和治疗手段的效率,极大地减轻病人的痛苦。
不过,虽然理论上证明了可行性,但这项技术在临床应用之前还需要大量的测试。因为这只是一个前沿性的证明,研究人员还没有分析释放的药物对肿瘤的影响。他们也不知道猿猴或者人的免疫系统会对细菌注射做出怎样的反应。
不可置否的是,这项技术不仅开阔了纳米机器人的新视野,创造了更先进的工程理念和干预方法,同时也开启了靶向治疗和成像以及诊断试剂的新篇章。
作者:周梦亚
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









这种细菌好获取吗
61
好熟悉,好好研究
59
#精准#
37
#癌细胞#
28
学习了,赞一个!!!
54