Nature:袁刚等发现,NSD3组蛋白甲基化活性升高促使肺鳞状细胞癌发生
2021-02-04 haibei MedSci原创
与其他8p11-12候选LUSC驱动因素相比,NSD3的表达增加与其基因扩增密切相关。在LUSC小鼠模型中,NSD3的敲除,而不是FGFR1的敲除,减轻了肿瘤的生长,并延长了生存期。
染色体区域8p11-12的扩增是一种常见的遗传改变,已有的研究显示,其与肺鳞状细胞癌(LUSC)的病因学存在一定的联系。FGFR1基因是该区域内肿瘤发生的主要候选驱动因素。然而,在临床试验评估中,FGFR1抑制作为一种靶向治疗一直没有成功。

最近,研究人员发现,组蛋白H3赖氨酸36(H3K36)甲基转移酶NSD3的基因位于8p11-12扩增子,并且该蛋白可以作为LUSC肿瘤发生的关键调节器。
与其他8p11-12候选LUSC驱动因素相比,NSD3的表达增加与其基因扩增密切相关。在LUSC小鼠模型中,NSD3的敲除,而不是FGFR1的敲除,减轻了肿瘤的生长,并延长了生存期。
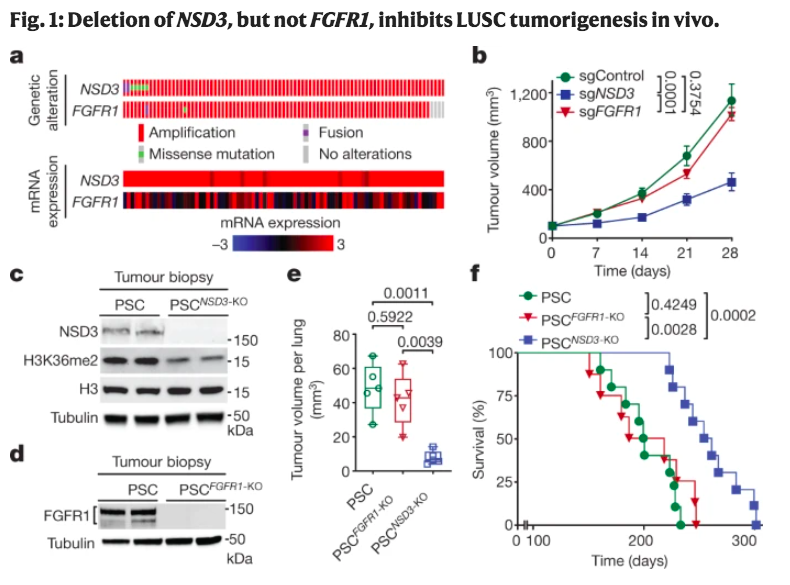
研究人员还鉴定了一个LUSC相关变体NSD3(T1232A),该变体在体外和体内对H3K36(H3K36me2)的二甲基化催化活性增加。结构动态分析显示,T1232A取代引起了整个NSD3催化域的局部流动性变化,以缓解自动抑制,增加H3底物的可及性。
NSD3(T1232A)在体内的表达加速了LUSC小鼠模型的肿瘤发生,降低了总生存率。NSD3(T1232A)病理生成H3K36me2,重新规划染色质景观,促进致癌基因表达标志。
此外,NSD3以依赖其催化活性的方式,促进了人气管支气管细胞的转化和异种移植人LUSC细胞系的生长,并扩增了8p11-12。
从含有NSD3扩增或NSD3(T1232A)编码变体的原代LUSCs患者衍生的异种移植中耗竭NSD3,可减轻小鼠肿瘤生长。
最后,研究人员发现,NSD3调控的LUSC衍生的异种移植物对溴化酶抑制高度敏感。
因此,该研究工作确定了NSD3是LUSC中一个主要的8p11-12扩增子相关的致癌驱动因子,并提示NSD3依赖性使LUSC在治疗上易受溴化酶抑制。
原始出处:
Gang Yuan et al. Elevated NSD3 histone methylation activity drives squamous cell lung cancer. Nature (2021).
作者:haibei
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#细胞癌#
60
#肺鳞状细胞癌#
92
#Nat#
54
#组蛋白#
116