Cell Host & Microbe:这种肠道细菌促进结肠息肉癌变,可作为癌症预测指标
2021-09-26 “生物世界”公众号 “生物世界”公众号
2021年9月17日,华盛顿大学的研究团队在 Cell 子刊 Cell Host & Microbe 上发表了题为:Genomic and functional characterization of
结直肠癌(CRC)是一种常见的癌症,它始于一种称为息肉的癌前病变。结肠直肠息肉是由结肠上皮内层的增殖与凋亡障碍引起的。管状腺瘤性息肉(TAP)和无蒂锯齿状息肉(SSP)是两种具有较高恶性潜能的癌前病变,它们的外观和分子特征明显不同。迄今为止,还没有研究报道 TAP 和 SSP 病变之间的微生物群的组成和功能差异。
我们的肠道中定殖了超过1000种细菌,它们组成了肠道微生物群,也是人类身体健康的基础之一。肠道微生物群的改变与结直肠息肉有关。某些细菌已被确定为可能的致癌驱动因素,这些细菌通过毒力机制促进肿瘤发展,表明细菌的慢性感染和炎症有助于肿瘤的发生和发展。然而,细菌在息肉发展中的作用尚不清楚。
2021年9月17日,华盛顿大学的研究团队在 Cell 子刊 Cell Host & Microbe 上发表了题为:Genomic and functional characterization of a mucosal symbiont involved in early-stage colorectal cancer 的研究论文。
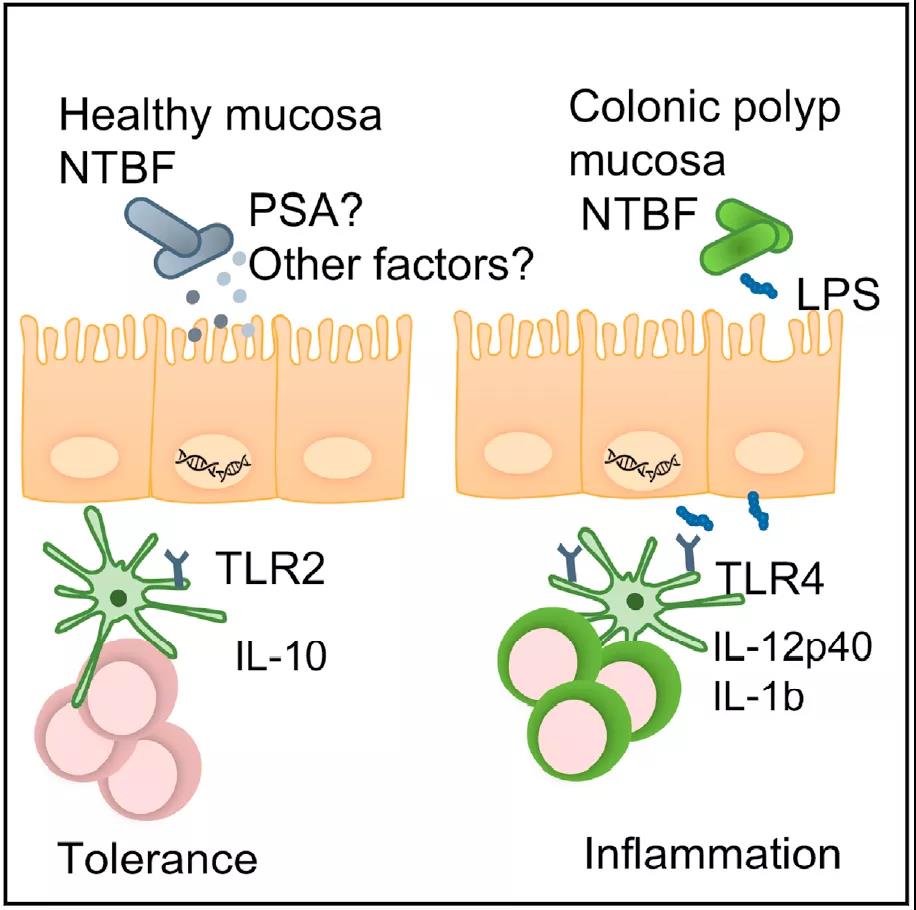
该研究发现脆弱拟杆菌与息肉附近粘膜中炎性细胞因子的水平之间存在相关性。来自息肉患者的脆弱拟杆菌通过 Toll 样受体 4 激活 NF-κB,诱导促炎反应,并富含与 LPS 生物合成相关的基因。该研究通过突出菌株特异性基因组和蛋白质组差异,以及微生物组中更广泛的组成差异,证明了脆弱拟杆菌促进结肠息肉的癌变,可以作为结直肠癌的风险预测指标。

研究团队招募了 40 名接受常规结肠镜检查的患者。患者年龄在 50 至 75 岁之间,其中 2/3 是女性。活检息肉的组织学分析显示,51% 的患者患有管状腺瘤性息肉 (TAP),23% 患有无蒂锯齿状息肉(SSP),13% 患有良性增生性息肉(HP),剩余的13% 没有病变,被作为健康对照。
研究团队对 TAP 和 SSP 息肉活检样本进行了免疫组化染色和宿主细胞因子水平测定,他们观察到上皮细胞过度增殖,并检测到促炎标志物 IL-17、IL-12p40、巨噬细胞炎症蛋白和髓过氧化物酶的粘膜炎症迹象。
肠道炎症与肠道微生物群组成的变化有关。因此,研究团队通过 16S rRNA 测序分析了一部分患者近端结肠的粘膜微生物群,看看这是否可以解释在宿主组织中观察到的表型差异。正如预期的那样,他们发现与息肉相关的微生物群的组成不同于健康组织。其中 TAP 组织主要包含拟杆菌,SSP 组织以变形菌为主,健康对照活检中主要包含厚壁菌。
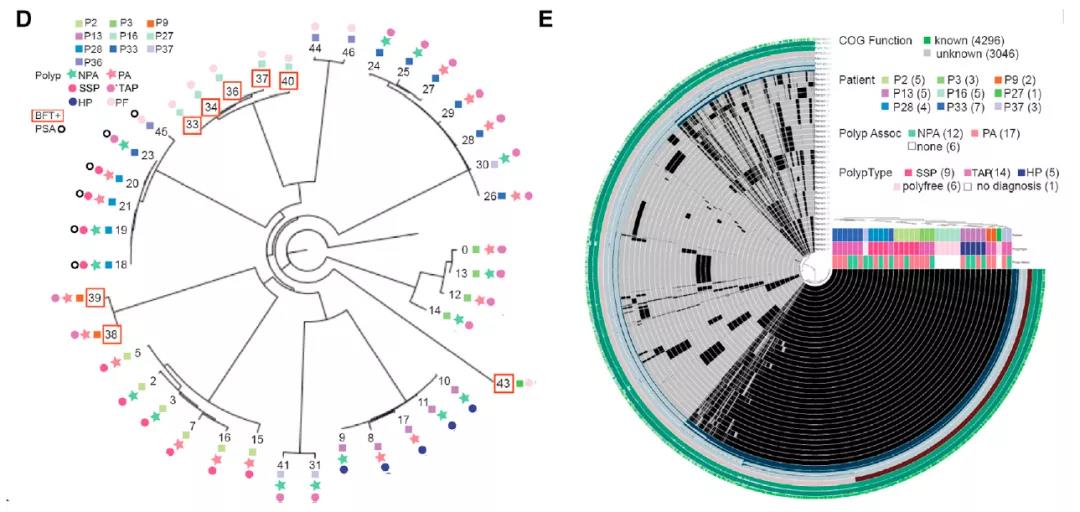
由于对息肉微生物组的研究很少,因此将细菌培养与基质辅助激光解吸电离飞行时间质谱(MALDI TOF MS)结合的培养组学使他们能够评估和比较在组间细菌的组成与功能。当与 16S 测序鉴定的细菌相比时,他们发现培养组学分析出更多的拟杆菌,这些细菌主要来自 TAP 患者的组织,然后是 SSP,最后是健康对照。对拟杆菌属的分析表明,拟杆菌中分别超过 80% 和 60% 是来自 TAP 或 SSP 的脆弱拟杆菌,健康对照中只有不到20%的脆弱拟杆菌。

经过仔细检查,研究团队发现,与来自无息肉个体的脆弱拟杆菌相比,来自息肉患者的脆弱拟杆菌在诱发炎症的能力方面更为强大。全基因组测序揭示了脆弱拟杆菌在其基因组中携带编码荚膜多糖 A(PSA)和 6 型分泌系统(T6SS)的基因,它们还携带可改善肠道黏膜附着的粘附素,以及各种抗生素抗性基因(cepA、tetQ和ermF)的存在,可使脆弱拟杆菌抵抗抗生素清除。
除了可以通过 TLR2 检测到的多糖和脂蛋白外,脆弱拟杆菌还产生一种独特的 LPS,已被证明与TLR4弱结合。使用 TLR4/MD2 和 NF-κB 依赖性萤火虫荧光素酶报告基因转染的细胞,与来自健康对照患者的细菌分离物相比,来自息肉患者的脆弱拟杆菌能够在更大程度上显着激活 TLR4。蛋白质组学差异解释了 TLR4 的不同刺激并导致 TAP 和 SSP脆弱拟杆菌的促炎表型。与 PF 分离株相比,息肉患者分离株中显着富集编码参与 LPS 生物合成的糖基转移酶的基因。已有研究报道TLR4 将 LPS 识别为微生物配体并且 LPS 可以通过 TLR4 发出信号以诱导 IL-12p40 和 IL-1β,LPS 生物合成的差异很可能解释了脆弱拟杆菌分离株之间观察到的表型差异。此外,与健康对照粘膜组织相比,TAP 和 SSP 组织切片中的LPS染色更强。

综上所述,这项工作表明癌前结肠息肉微环境富含刺激TLR4而不是TLR2 的脆弱拟杆菌,导致促炎细胞因子的诱导。在息肉形成的早期阶段,发炎的肠道微环境允许富含 LPS 生物合成基因的脆弱拟杆菌进行定植。这些细菌通过 TLR4 激活 NF-kB 并诱导炎症,直接促进结肠肿瘤的生长。这项研究的发现为微生物群诱导结直肠癌能力的潜在机制提供了基本见解,并且在发现潜在的基于微生物群的结直肠癌诊断和治疗靶点方面向前迈进了一步。
原始出处:
Melissa C.Kordahi, et al. Genomic and functional characterization of a mucosal symbiont involved in early-stage colorectal cancer. Cell Host & Microbe, 2021.
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#Micro#
72
#CEL#
66
#CRO#
81
#Cell#
86
#肠道细菌#
119